1.本发明涉及农学领域,具体地,本发明涉及一种增强植物对细菌的抗性的方法。
背景技术:
2.环境胁迫对植物的生长发育和生存造成很大影响,严重威胁作物产量。茄科雷尔氏菌(r.solanacearum),又称青枯菌,是250多种植物中青枯病的病原体,其中包括重要的经济作物,如番茄、马铃薯、辣椒、茄子或香蕉。此外,青枯菌对中国的几种农作物构成重要威胁。在农作物中,茄科植物,如番茄或马铃薯,是受青枯病影响严重的重要作物。
3.作为一种土传细菌,青枯菌通过根部入侵植物,侵入木质部导管,并迅速在整个植物上定殖。青枯菌营半生物营养的行为,在感染的早期阶段在活组织中增殖,随后大量的细菌复制和胞外多糖的分泌会导致木质部导管堵塞和维管功能性障碍,最终导致植物的枯萎和死亡。在植物死亡之前,受感染的植物可以容纳大量的细菌菌群,每克植物组织中的细菌个数可高达1010个。由此,枯萎和崩溃的植物组织返回至土壤中,形成了高浓度细菌接种物,为下次潜在的入侵宿主植物创造了有利条件,从而延续了青枯病菌的致病循环。
4.尽管在过去的几年里,大量的科学研究使我们对植物胁迫(生物和非生物的)和代谢适应相关的植物信号通路分别有了更多的了解,但我们对这些通路之间的联系仍然知之甚少,因此也限制了利用代谢通路的产物来增强作物的防御和抗病能力。
5.因此,本领域迫切需要开发一种能够提高植物对细菌,比如青枯菌的抗性的方法。
技术实现要素:
6.本发明的目的就是提供一种能够提高植物对细菌,比如青枯菌的抗性的方法。
7.本发明的第一方面提供了一种丙酮酸脱羧酶介导的代谢途径相关物质的用途,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合,用于增强植物对细菌的抗性,或制备一组合物或制剂,所述制剂或组合物用于增强植物对细菌的抗性。
8.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质包括丙酮酸和乙酸。
9.在另一优选例中,所述细菌选自下组:青枯菌、丁香假单胞菌、或其组合。
10.在另一优选例中,所述青枯菌为青枯菌属(ralstonia solanacearum)。
11.在另一优选例中,所述制剂或组合物还用于选自下组的一种或多种用途:
12.(a)激活丙酮酸脱羧酶介导的代谢途径;
13.(b)激活乙酸诱导的茉莉酸合成途径;
14.(c)提高植物抗生物胁迫的抗性。
15.在另一优选例中,所述的组合物为农用组合物。
16.在另一优选例中,所述组合物包含(a)丙酮酸脱羧酶介导的代谢途径相关物质,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合;和(b)农学上可接受的载体。
17.在另一优选例中,所述组合物还包括其他用于增强植物对细菌的抗性的物质。
18.在另一优选例中,所述其他用于增强植物对细菌的抗性的物质包括青枯立克。
19.在另一优选例中,所述组合物还包括pdc基因或其编码蛋白或其促进剂。
20.在另一优选例中,所述促进剂包括促进pdc基因或其编码蛋白表达和/或提高pdc活性的物质。
21.在另一优选例中,所述的促进剂选自下组:小分子化合物、核酸分子、或其组合。
22.在另一优选例中,所述组合物或制剂的剂型选自下组:溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、或其组合。
23.在另一优选例中,所述植物包括茄科、豆科、芭蕉科、香蕉科、油橄榄科、十字花科。
24.在另一优选例中,所述植物包括茄属、大豆属、烟草属、拟南芥属。
25.在另一优选例中,所述植物包括番茄、大豆、烟草、香蕉、油橄榄、拟南芥。
26.本发明第二方面提供了一种组合物,包括:
27.(a)丙酮酸脱羧酶介导的代谢途径相关物质,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合;
28.(b)农学上可接受的载体。
29.在另一优选例中,所述组合物包括农用组合物。
30.在另一优选例中,所述组合物的剂型选自下组:溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、或其组合。
31.在另一优选例中,所述组合物中,含有0.0001-99wt%,较佳地0.1-90wt%的组分(a),以所述组合物的总重量计。
32.在另一优选例中,所述组合物还包括pdc基因或其编码蛋白或其促进剂。
33.在另一优选例中,所述组合物还包括其他用于增强植物对细菌的抗性的物质。
34.在另一优选例中,所述其他用于增强植物对细菌的抗性的物质包括青枯立克。
35.本发明第三方面提供了一种本发明第二方面所述的组合物的用途,用于增强植物对细菌的抗性。
36.本发明第四方面提供了一种增强植物细菌抗性的方法,包括步骤:
37.给所述植物施用丙酮酸脱羧酶介导的代谢途径相关物质,或施用本发明第二方面所述的组合物,其中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
38.在另一优选例中,所述施用包括喷洒或灌溉。
39.在另一优选例中,所述施用的剂量为2-30mm/株,较佳地,8-25mm/株,更佳地,10-20mm/株。
40.在另一优选例中,所述施用的剂量为0.5-8l/公顷,较佳地2-6l/公顷,更佳地,3-5l/公顷。
41.在另一优选例中,所述施用的剂量为2.5-100μl/株,较佳地10-60μl/株,更佳地,20-40μl/株。
42.本发明第五方面提供了一种pdc基因或其编码蛋白或其促进剂的用途,用于增强植物对细菌的抗性,或制备一组合物或制剂,所述制剂或组合物用于增强植物对细菌的抗性。
43.在另一优选例中,所述制剂或组合物在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物对细菌的抗性。
44.在另一优选例中,所述制剂或组合物在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物针对细菌的抗生物胁迫能力。
45.在另一优选例中,所述细菌选自下组:青枯菌、丁香假单胞菌、或其组合。
46.在另一优选例中,所述青枯菌为青枯菌属(ralstonia solanacearum)。
47.在另一优选例中,所述促进剂包括促进pdc基因或其编码蛋白表达和/或提高pdc活性的物质。
48.在另一优选例中,所述的促进剂选自下组:小分子化合物、核酸分子、或其组合。
49.在另一优选例中,所述促进pdc表达或活性指将pdc基因或蛋白的表达或活性提高≥20%,较佳地,≥50%,更佳地,≥70%。
50.在另一优选例中,所述制剂或组合物还用于选自下组的一种或多种用途:
51.(d)激活丙酮酸脱羧酶介导的代谢途径;
52.(e)激活乙酸诱导的茉莉酸合成途径;
53.(f)提高植物抗生物胁迫的抗性。
54.在另一优选例中,所述的组合物为农用组合物。
55.在另一优选例中,所述组合物包含(a)pdc基因或其编码蛋白或其促进剂;和(b)农学上可接受的载体。
56.在另一优选例中,所述组合物还包括丙酮酸脱羧酶介导的代谢途径相关物质。
57.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
58.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质包括丙酮酸和乙酸。
59.在另一优选例中,所述组合物还包括还包括其他用于增强植物对细菌的抗性的物质。
60.在另一优选例中,所述其他用于增强植物对细菌的抗性的物质包括青枯立克。
61.在另一优选例中,所述组合物或制剂的剂型选自下组:溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、或其组合。
62.在另一优选例中,所述植物包括茄科、豆科、芭蕉科、香蕉科、油橄榄科、十字花科。
63.在另一优选例中,所述植物包括茄属、大豆属、烟草属、拟南芥属。
64.在另一优选例中,所述植物包括番茄、大豆、烟草、香蕉、油橄榄、拟南芥。
65.在另一优选例中,所述pdc来源于单子叶植物或双子叶植物。
66.在另一优选例中,所述植物选自下组:茄科、十字花科、或其组合。
67.在另一优选例中,所述pdc来源于选自下组的一种或多种植物:茄科、十字花科、豆科、芭蕉科、香蕉科、油橄榄科。
68.在另一优选例中,所述pdc来源于选自下组的一种或多种植物:番茄、芒果、花生、大豆、烟草、香蕉、油橄榄、拟南芥。
69.在另一优选例中,所述pdc选自下组:番茄的pdc基因(slpdc2,xp_010323135.1)、拟南芥的pdc基因(atpdc2,q9fft4.1)、花生的pdc基因(pdc1,ay227204.1)、芒果的pdc基因
(pdc1,aci41983.1)、或其组合。
70.在另一优选例中,所述pdc基因包括野生型pdc基因和突变型pdc基因。
71.在另一优选例中,所述的突变型包括突变后编码蛋白的功能未发生改变(即功能与野生型编码蛋白相同或基本相同)和功能增强的突变形式。
72.在另一优选例中,所述的突变型pdc基因编码的多肽与野生型pdc基因所编码的多肽相同或基本相同。
73.在另一优选例中,所述的突变型pdc基因包括与野生型pdc基因相比,同源性≥80%(较佳地≥90%,更佳地≥95%,更佳地,≥98%或99%)的多核苷酸。
74.在另一优选例中,所述的突变型pdc基因包括在野生型pdc基因的5'端和/或3'端截短或添加1-60个(较佳地1-30,更佳地1-10个)核苷酸的多核苷酸。
75.在另一优选例中,所述pdc基因包括野生型pdc基因和突变型pdc基因。
76.在另一优选例中,所述的突变型包括突变后编码蛋白的功能未发生改变(即功能与野生型编码蛋白相同或基本相同)和功能增强的突变形式。
77.在另一优选例中,所述的突变型pdc基因编码的多肽与野生型pdc基因所编码的多肽相同或基本相同。
78.在另一优选例中,所述的突变型pdc基因包括与野生型pdc基因相比,同源性≥80%(较佳地≥90%,更佳地≥95%,更佳地,≥98%或99%)的多核苷酸。
79.在另一优选例中,所述的突变型pdc基因包括在野生型pdc基因的5'端和/或3'端截短或添加1-60个(较佳地1-30,更佳地1-10个)核苷酸的多核苷酸。
80.在另一优选例中,所述pdc蛋白的氨基酸序列选自下组:
81.(i)具有seq id no.:1或3所示氨基酸序列的多肽;
82.(ii)将如seq id no.:1或3所示的氨基酸序列经过一个或几个(如1-10个)氨基酸残基的取代、缺失或添加而形成的,具有所述增强植物对细菌的抗性活性的、由(i)衍生的多肽;或
83.(iii)氨基酸序列与seq id no.:1或3所示氨基酸序列的同源性≥80%(较佳地≥90%,更佳地≥95%或≥98%),具有所述pdc活性的多肽。
84.在另一优选例中,所述pdc基因的核苷酸序列选自下组:
85.(a)编码如seq id no.:1或3所示多肽的多核苷酸;
86.(b)序列如seq id no.:2或4所示的多核苷酸;
87.(c)核苷酸序列与seq id no.:2或4所示序列的同源性≥75%(较佳地≥85%,更佳地≥90%或≥95%)的多核苷酸;
88.(d)在seq id no.:2或4所示多核苷酸的5'端和/或3'端截短或添加1-60个(较佳地1-30,更佳地1-10个)核苷酸的多核苷酸;
89.(e)与(a)-(d)任一所述的多核苷酸互补的多核苷酸。
90.本发明第六方面提供了一种组合物,包括:
91.(a)pdc基因或其编码蛋白或其促进剂;
92.(b)农学上可接受的载体。
93.在另一优选例中,所述组合物包括农用组合物。
94.在另一优选例中,所述组合物的剂型选自下组:溶液剂、乳剂、混悬剂、粉剂、泡沫
剂、糊剂、颗粒剂、气雾剂、或其组合。
95.在另一优选例中,所述组合物中,含有0.0001-99wt%,较佳地0.1-90wt%的组分(a),以所述组合物的总重量计。
96.在另一优选例中,所述的促进剂选自下组:小分子化合物、核酸分子、或其组合。
97.在另一优选例中,所述组合物还包括丙酮酸脱羧酶介导的代谢途径相关物质。
98.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
99.在另一优选例中,所述组合物还包括其他用于增强植物对细菌的抗性的物质。
100.在另一优选例中,所述其他用于增强植物对细菌的抗性的物质包括青枯立克。
101.本发明第七方面提供了一种本发明第六方面所述的组合物的用途,用于增强植物对细菌的抗性。
102.在另一优选例中,所述组合物在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物对细菌的抗性。
103.在另一优选例中,所述组合物在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物针对细菌的抗生物胁迫能力。
104.本发明第八方面提供了一种增强植物对细菌的抗性的方法,包括步骤:
105.提高所述植物中(a)pdc基因或其编码蛋白的表达量和/或活性,从而增强植物对细菌的抗性。
106.在另一优选例中,所述方法在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物对细菌的抗性。
107.在另一优选例中,所述方法在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物针对细菌的抗生物胁迫能力。
108.在另一优选例中,所述方法包括给予植物(a)pdc基因或其编码蛋白或其促进剂。
109.在另一优选例中,所述促进剂为促进pdc基因或其编码蛋白表达和/或提高pdc活性的物质。
110.在另一优选例中,所述的促进剂选自下组:小分子化合物、核酸分子、或其组合。
111.在另一优选例中,所述方法包括向植物中导入外源的pdc基因。
112.在另一优选例中,所述方法包括向植物中导入促进内源的pdc基因或其编码蛋白表达的物质。
113.在另一优选例中,所述方法包括促进植物中内源的pdc基因或其编码蛋白的表达。
114.在另一优选例中,所述方法包括步骤:
115.(i)提供一植物或植物细胞;和
116.(ii)将pdc基因序列导入所述植物或植物细胞,从而获得转基因的植物或植物细胞。
117.在另一优选例中,所述方法包括步骤:
118.(a)提供携带pdc基因序列的表达载体的农杆菌;
119.(b)将植物细胞或组织或器官与步骤(a)中的农杆菌接触,从而使pdc基因的基因序列转入植物细胞,并且整合到植物细胞的染色体上;
120.(c)选择已转入pdc基因序列的植物细胞或组织或器官;和
121.(d)将步骤(c)中的植物细胞或组织或器官再生为植株。
122.在另一优选例中,所述植物组织或植物细胞中的pdc基因或其编码蛋白的表达量或活性提高了≥5%,≥10%,≥20%,更佳地,≥50%。
123.在另一优选例中,所述“提高”是指pdc基因或其编码蛋白的表达或活性提高满足以下条件:
124.a1/a0的比值≥5%,更佳地,≥10%,更佳地≥20%,最佳地为50-200%;其中,a1为植物组织或植物细胞中pdc基因或其编码蛋白的表达或活性;a0为野生型同种类型植物组织或植物细胞中相同pdc基因其编码蛋白的表达或活性。
125.在另一优选例中,所述植物中pdc基因的活性e1与野生型同种类型的植物中的相同pdc基因的本底活性e0之比(e1/e0)≥2倍,较佳地≥5倍,更佳地≥10倍。
126.在另一优选例中,所述方法还包括给予植物丙酮酸脱羧酶介导的代谢途径相关物质。
127.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
128.在另一优选例中,所述方法还包括给予其他用于增强植物对细菌的抗性的物质。
129.本发明第九方面提供了一种制备基因工程的植物组织或植物细胞的方法,包括步骤:
130.提高植物组织或植物细胞中的pdc基因或其编码蛋白的表达量和/或活性,从而获得基因工程的植物组织或植物细胞。
131.在另一优选例中,所述方法在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物对细菌的抗性。
132.在另一优选例中,所述方法在低氧环境中或丙酮酸脱羧酶介导的代谢途径相关物质存在下增强植物针对细菌的抗生物胁迫能力。
133.在另一优选例中,所述方法还包括给予植物丙酮酸脱羧酶介导的代谢途径相关物质。
134.在另一优选例中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
135.在另一优选例中,所述方法还包括给予其他用于增强植物对细菌的抗性的物质。
136.在另一优选例中,所述的基因工程包括转基因。
137.在另一优选例中,所述方法还包括向植物组织或植物细胞中导入pdc基因或其编码蛋白或其促进剂。
138.本发明第十方面提供了一种制备性状改良的植物的方法,包括步骤:
139.将本发明第九方面所述方法制备的基因工程的植物组织或植物细胞再生为植物体,从而获得性状改良的植物。
140.在另一优选例中,所述的性状包括增强植物对细菌的抗性。
141.本发明第十一方面提供了一种基因工程植株,所述植株中导入pdc基因或其编码蛋白、或其促进剂或所述的植株是用本发明第十方面所述的方法制备的。
142.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在
此不再一一累述。
附图说明
143.下列附图用于说明本发明的具体实施方案,而不用于限定由权利要求书所界定的本发明范围。
144.图1显示了青枯菌的侵染可显著地增强植物中丙酮酸脱羧酶活性。
145.(a)青枯菌侵染可显著地增强拟南芥幼苗中丙酮酸脱羧酶活性。用青枯菌接种8日龄拟南芥幼苗根系,青枯菌种gmi1000为实验组,水处理为对照组。(b)青枯菌侵染可显著地增强番茄茎中丙酮酸脱羧酶活性。用3.5周龄番茄植株于茎部注射青枯菌,青枯菌种gmi1000为实验组,水处理为对照组。植物中丙酮酸脱羧酶活性测定相对于对照组的百分比。星号表示显著性差异,使用学生t检验(p《0.001)。数值代表平均值
±
sem(n=8)。3次重复实验呈现的结果相似。
146.图2显示了植物中slpdc2基因对青枯菌的抗性发挥作用。
147.(a)qrt-pcr检测拟南芥pdc2突变株中atpdc2的基因表达。数据用atactin的基因表达作为内参,野生型中的基因表达作为对照。数值表示平均值
±
sem(n=3个样本,每个基因型),星号表示显著性差异,使用学生t检验(p《0.0001)。(b和c)用青枯菌gmi1000对拟南芥植株浸土接种分析。(n≥15,每个基因型)。(d)qrt-pcr检测slpdc2 rnai的番茄根系中slpdc2的基因表达。数据用slef1α的基因表达作为内参,空的表达载体(ev)的番茄根系中的基因表达作为对照。数值表示平均值
±
sem(n=3个样本,每个基因型),星号表示显著性差异,使用学生t检验(p《0.0001)。(e和f)用青枯菌gmi1000对番茄植株浸土接种分析,番茄根系上表达有空载体(ev)或表达沉默的slpdc2-rnai。(n≥8,每个基因型)。在b、e中,结果以疾病发生程度表示,从0到4(均值
±
sem)的范围内显示所有植株的枯萎症状平均值。c、f分别表示b、e中数据的存活率分析;将疾病评分转换成具有如下标准的二进制数据:对于每个特定时间点(dpi),疾病指数小于2被定义为“0”,而等于或大于2的疾病指数被定义为“1”。使用mantel-cox检验进行显著性统计分析,并在图中标注相应的p值。
148.图3显示了丙酮酸脱羧酶介导的代谢途径有助于番茄对青枯菌的抗性。
149.2周龄番茄植株用指定的30mm有机酸溶液或水(阴性对照)预处理后,进行gmi1000浸土接种分析。用30mm的丙酮酸、乙酸或甲酸溶液对2周龄番茄植株进行预处理,每天每株10ml,连续处理9天。9天后,在不破坏根部的情况下,用水轻轻冲洗jiffy pot几次,以去除土壤中的残留酸,正常生长3天后,接种青枯菌。数据来自于7个独立生物学重复实验的整合数据。所有数值汇总在一起,分别展示为疾病指数(a)或存活率(b)。病情指数值代表均值
±
sem(n=74),统计分析采用(mantel-cox检验进行显著性差异分析,相应的p值以与每条曲线相同的颜色标注在图表中。(c)接种gmi1000后17天的植株图像。
具体实施方式
150.经过广泛而深入的研究,本发明人意外发现,丙酮酸脱羧酶介导的代谢途径相关物质(如丙酮酸、和/或乙酸)可增强植物对细菌(如青枯菌)的抗性。此外,通过对大量的植物性状位点的研究和筛选,还意外发现,在低氧条件或丙酮酸脱羧酶介导的代谢途径相关物质存在下,提高所述植物(如番茄、拟南芥)中pdc基因或其编码蛋的表达量或活性,也可
显著增强植物对细菌(如青枯菌)的抗性。在此基础上,发明人完成了本发明。
151.丙酮酸脱羧酶介导的代谢途径相关物质
152.在本发明中,丙酮酸脱羧酶介导的代谢途径相关物质是指参与丙酮酸脱羧酶介导的代谢途径的物质。
153.在一优选实施方式中,丙酮酸脱羧酶介导的代谢途径相关物质包括但并不限于,丙酮酸、乙酸。
154.pdc基因
155.在缺氧条件下,植物利用丙酮酸脱羧酶(pdcs)将丙酮酸转化为乙醛参与发酵过程,乙醛可继续被乙醛脱氢酶(aldh)降解为乙酸。pdc基因本底水平下表达量较低,但在缺氧、干旱和其他胁迫条件下表达显著上调。
156.如本文所用,术语“本发明的pdc基因”、“pdc基因”可互换使用,均指来源于西红柿、芒果、花生、番茄或拟南芥的pdc基因或其变体。
157.在一优选实施方式中,本发明的pdc基因的核苷酸序列如seq id no.:2或4所示。
158.本发明还包括与本发明的基因序列(seq id no.:2或4)具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的核酸,所述核酸也能有效地调控植物(如番茄、拟南芥)的性状。“同源性”是指按照位置相同的百分比,两条或多条核酸之间的相似水平(即序列相似性或同一性)。
159.在本发明中,seq id no.:2或4中的核苷酸序列可以经过取代、缺失或添加一个或多个(通常为1-90个,较佳地1-60个,更佳地1-20个,最佳地1-10个),以及在5’和/或3’端添加数个(通常为60个以内,较佳地为30个以内,更佳地为10个以内,最佳地为5个以内)核苷酸,生成seq id no.:2或4的衍生序列,由于密码子的简并性,即使与seq id no.:2或4的同源性较低,也能基本编码出如seq id no.:1或3所示的氨基酸序列。
160.另外,“在seq id no.:2或4中的核苷酸序列经过取代、缺失或添加至少一个核苷酸衍生序列”的含义还包括能在中度严谨条件下,更佳的在高度严谨条件下与seq id no.:2或4所示的核苷酸序列杂交的核苷酸序列。这些变异形式包括(但并小限于):若干个(通常为1-90个,较佳地1-60个,更佳地1-20个,最佳地1-10个)核苷酸的缺失、插入和/或取代,以及在5’和/或3’端添加数个(通常为60个以内,较佳地为30个以内,更佳地为10个以内,最佳地为5个以内)核苷酸。
161.应理解,尽管本发明的实例中提供的基因来源于番茄、拟南芥,但是来源于其它类似的植物(尤其是与番茄属于同一科或属的植物或与番茄的同源性比较高的其他科或属的植物)的、与本发明的序列(优选地,序列如seq id no.:2或4所示)具有一定同源性(保守性,如具有80%以上,如85%,90%,95%甚至98%序列相同性)的pdc的基因序列,也包括在本发明的范围内,只要本领域技术人员在阅读了本技术后根据本技术提供的信息可以方便地从其它植物中分离得到该序列,比对序列相同性的方法和工具也是本领域周知的,例如blast。
162.本发明的多核苷酸可以是dna形式或rna形式。dna形式包括:dna、基因组dna或人工合成的dna,dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seq id no.:2或4所示的编码区序列相同或者是简并的变异体。
163.编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序
列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
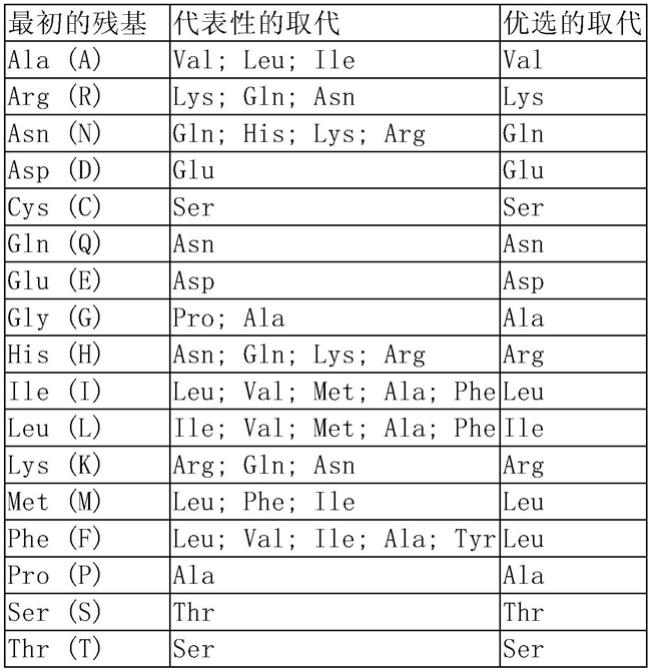
164.术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多苷或多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
165.本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酞胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。
166.本发明的pdc核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的dna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
167.此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
168.在一优选实施方式中,pdc的核苷酸序列如下所示:
169.》q9fft4.1,atpdc2(拟南芥pdc基因)
170.atggacactaagatcggatctatcgacgcgtgtaacccgaccaaccacgatatcggcggtcctccaaacggcggagtctccaccgttcaaaacacaagtccacttcactccaccaccgtcagcccctgcgacgcgactcttggccgttacctagcaagacggttagtcgaaatcggcgtcaccgatgtcttctccgttcctggtgatttcaacctgacgcttctcgatcacctaatcgccgaaccaaacctcaagctgatcggttgctgcaacgagcttaacgccggatacgctgctgacggttacgctagatctcgcggtgttggtgcgtgcgtcgttacgttcaccgtcggtggattgagtgttctgaatgcgatcgccggtgcttacagtgagaatctgcctctgatttgcatcgtcggtggtccaaactccaacgattacggtaccaataggattcttcatcatacaattggtttacctgatttcactcaagagcttaggtgttttcaagctgttacttgttttcaagctgtgattaataacttagaagaggctcatgaacttatcgatactgcgatttcaactgctttgaaagaaagcaaacctgtttatatcagtatcagctgtaatttaccggcgattcctcttccgacgtttagtcgtcatcctgttccgttcatgcttccgatgaaggttagcaatcagattggtttagatgcggcggtggaggcagctgctgagttcttgaacaaagctgtgaagccagttcttgttggtgggccgaaaatgcgggttgcgaaagccgcggatgcttttgttgagcttgctgatgcttctggctatggtcttgctgtgatgccttctgctaaaggacaagtacctgagcatcacaagcatttta
tagggacgtattggggagctgtgagtacagctttttgtgctgaaatcgttgaatctgcggatgcttatctgtttgcaggtccgattttcaacgattacagttctgttgggtattctctgcttctcaagaaggagaaggcaatcatcgttcagcctgatcgggttactatcggtaacggacctgcgtttggatgtgttcttatgaaggattttctaagcgagttggctaaacgaattaagcacaacaacacttcttatgagaattatcacaggatctatgtcccagaaggaaagcctttgagagataacccgaatgagtctttgagggttaatgtactgttccaacacattcagaatatgctctcttctgagtctgctgtgcttgctgagacaggagattcctggttcaactgtcagaagctgaagctccctgaaggatgcggttacgaattccaaatgcagtacggatcaattggctggtcagtgggtgctactctaggctatgctcaagccatgccaaacaggcgtgtcattgcttgtattggagatggtagtttccaggtaaccgcacaggatgtatctacgatgatacggtgtgggcaaaagaccataatcttcctcatcaacaacggaggctacaccattgaggtggaaattcacgatggtccttacaatgtcataaagaactggaactacacagcttttgttgaggccatacacaatggagaaggaaaatgctggactgccaaggtgagatgcgaggaggagttagtgaaagcaatcaacacggcaaccaatgaggaaaaagagagcttttgtttcattgaagtgatagtgcacaaagacgatacaagcaaggaacttttggagtggggctctagagtctctgctgctaatagtcgtcccccaaatccgcagtag(seq id no.:2)
171.》xp_010323135.1,slpdc2(番茄pdc基因)
172.atggaaggtaacaatgccatcggttccacggctcagtcagcttcagttccagcgagctctccgtgtggagctggaactctgggtcggcacttggctcgtcggctagtacaaatcggtgtgaaggatgtgttttcggttcccggcgacttcaacttgacgttgctcgatcatctgattgccgagccggagctaaatttgatcggctgctgtaacgaactaaacgctgggtacgccgccgacgggtacgcacgtgcgaaaggggtgggggcatgtgtagtgacgttcactgtagggggactaagtgtgcttaatgctattgctggggcatacagtgagaatttgcctgtgatttgtattgttggtggaccgaattcgaatgactatggtacgaacagaattttgcatcatactattggcctaccagattttagccaggaacttagatgctttcaaactgttacttgttctcaggcagtggtgaataacttggatgatgcacatgaattgattgatactgcaatttcaactgctctaaaggagagcaagccagtttacattagcataggttgtaatttgcctgggattgctcacccaacatttgctagagaacctgttccattctatcttgctccaaaggtcagcaatcaactaggattagaagcagctgttgaagcagcagcagagttcttgaacaagtctgtgaaaccagttattgtgggaggtcccaaagtaagagtgggaaaagcacaaaaggcctttgtggaacttgctgatgcatgtggctatccgttggcagtaatgccatctggtaagggactggtgccagagcaccaccctagtttcattgggacatactggggagcagtgagttcgagtttttgtggggagattattgaatcagcggatgcttatgtctttgtcggccccatattcaatgactacagctctgttggatactcattgctgattaaaaaggagaagttgattgttgttgaacctcatcgtgtgactattggaaatggcccctcctttggttgggttttcatgactgatttcttaagtgcattggccaaaaagctgaagaagaattccactgctttggaaaatcaccatcgtatttatgtccctccgggtgttgccttgaaacgcgagaaggatgaacttcttcgagtcaatatactcttcaagcacattcaggaaatgctaagcggtaacactgcagtgattgctgagaccggggactcatggttcaattgtcagaagctaaatcttccagaaaattgcgggtttgaattccagatgcagtatggatccattggctggtcagtcggtgctactctcggttatgctcaggctgctaaagataaacgtatcattgcctgcatcggggatggaagcttccaggttactgctcaggatatatcaaccatgataagatgtgcacaaaagaatattatatttctcatcaacaacggaggttataccattgaagtagagattcatgatggcccatataacgtgattaagaattgggactacactggtcttgtgaatgctatccataatggcgaaggcaaatgttggactgcaaaggtaaagacggaggaggacctaactgaggctatagcaacagcgacaagcacacacaaggactccttgtgtttcattgaagtctttgtgcacaaggatgatactagcaaagagcttttggaatggggatcgcgtgtttctgcagctaatagccgtcctcctaatcctcagtag(seq id no.:4)
173.pdc基因编码的多肽
174.如本文所用,术语“本发明多肽”、“pdc基因的编码蛋白”、可以互换使用,都是指来源于番茄、拟南芥的pdc的多肽及其变体。在一优选实施方式中,本发明多肽的一种典型的氨基酸序列如seq id no.:1或3所示。
175.本发明涉及一种调控植物性状的pdc多肽及其变体,在本发明的一个优选例中,所述多肽的氨基酸序列如seq id no.:1或3所示。本发明的多肽能够有效调控植物(如番茄、拟南芥)的性状,比如增强植物对细菌(比如青枯菌)的抗性。
176.本发明还包括与本发明的seq id no.:1或3所示序列具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。
177.所述“相同或相似功能”主要是指:“调控植物或农作物(如番茄、拟南芥)的性状,比如增强植物对细菌(比如青枯菌)的抗性”。
178.本发明的多肽可以是重组多肽、天然多肽、合成多肽。本发明的多肽可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的多肽可以是糖基化的,或可以是非糖基化的。本发明的多肽还可包括或不包括起始的甲硫氨酸残基。
179.本发明还包括具有本发明的蛋白活性的pdc蛋白片段和类似物。如本文所用,术语“片段”和“类似物”是指基本上保持本发明的天然pdc蛋白相同的生物学功能或活性的多肽。
180.本发明的多肽片段、衍生物或类似物可以是:(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的;或(ii)在一个或多个氨基酸残基中具有取代基团的多肽;或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽;或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
181.本发明中,所述的多肽变体是如seq id no.:1或3所示的氨基酸序列,经过若干个(通常为1-60个,较佳地1-30个,更佳地1-20个,最佳地1-10个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能,在c末端和/或末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。这些保守性变异最好根据表1进行替换而产生。
182.表1
[0183][0184][0185]
本发明还包括所要求保护的蛋白的类似物。这些类似物与天然seq id no.:1或3差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分了生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性的蛋白。
[0186]
修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白质合成和加工中进行糖基化修饰。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。
[0187]
在一优选实施方式中,pdc的氨基酸序列如下所示:
[0188]
》q9fft4.1,atpdc2(拟南芥pdc蛋白)
[0189]
mdtkigsidacnptnhdiggppnggvstvqntsplhsttvspcdatlgrylarrlveigvtdvfsvpgdfnltlldhliaepnlkligccnelnagyaadgyarsrgvgacvvtftvgglsvlnaiagaysenlplicivggpnsndygtnrilhhtiglpdftqelrcfqavtcfqavinnleeahelidtaistalkeskpvyisiscnlpaiplptfsrhpvpfmlpmkvsnqigldaaveaaaeflnkavkpvlvggpkmrvakaadafveladasgyglavmpsakgqvpe
hhkhfigtywgavstafcaeivesadaylfagpifndyssvgyslllkkekaiivqpdrvtigngpafgcvlmkdflselakrikhnntsyenyhriyvpegkplrdnpneslrvnvlfqhiqnmlssesavlaetgdswfncqklklpegcgyefqmqygsigwsvgatlgyaqampnrrviacigdgsfqvtaqdvstmircgqktiiflinnggytieveihdgpynviknwnytafveaihngegkcwtakvrceeelvkaintatneekesfcfievivhkddtskellewgsrvsaansrppnpq*(seq id no.:1)
[0190]
》xp_010323135.1,slpdc2(番茄pdc蛋白)
[0191]
megnnaigstaqsasvpasspcgagtlgrhlarrlvqigvkdvfsvpgdfnltlldhliaepelnligccnelnagyaadgyarakgvgacvvtftvgglsvlnaiagaysenlpvicivggpnsndygtnrilhhtiglpdfsqelrcfqtvtcsqavvnnlddahelidtaistalkeskpvyisigcnlpgiahptfarepvpfylapkvsnqlgleaaveaaaeflnksvkpvivggpkvrvgkaqkafveladacgyplavmpsgkglvpehhpsfigtywgavsssfcgeiiesadayvfvgpifndyssvgysllikkeklivvephrvtigngpsfgwvfmtdflsalakklkknstalenhhriyvppgvalkrekdellrvnilfkhiqemlsgntaviaetgdswfncqklnlpencgfefqmqygsigwsvgatlgyaqaakdkriiacigdgsfqvtaqdistmircaqkniiflinnggytieveihdgpynviknwdytglvnaihngegkcwtakvkteedlteaiatatsthkdslcfievfvhkddtskellewgsrvsaansrppnpq*(seq id no.:3)
[0192]
表达载体
[0193]
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或本发明突变蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。
[0194]
通过常规的重组dna技术,可利用本发明的多聚核苷酸序列可用来表达或生产本发明所述的蛋白或其变异体。一般来说有以下步骤:
[0195]
(1).用编码本发明蛋白或其变异体的多核苷酸,或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0196]
(2).在合适的培养基中培养的宿主细胞;
[0197]
(3).从培养基或细胞中分离、纯化蛋白质。
[0198]
本发明还提供了一种包括本发明的基因的重组载体。作为一种优选的方式,重组载体的启动子下游包含多克隆位点或至少一个酶切位点。当需要表达本发明目的基因时,将目的基因连接入适合的多克隆位点或酶切位点内,从而将目的基因与启动子可操作地连接。作为另一种优选方式,所述的重组载体包括(从5’到3’方向):启动子,目的基因,和终止子。如果需要,所述的重组载体还可以包括选自下组的元件:3’多聚核苷酸化信号;非翻译核酸序列;转运和靶向核酸序列;抗性选择标记(二氢叶酸还原酶、新霉素抗性、潮霉素抗性以及荧光蛋白等);增强子;或操作子。
[0199]
在本发明中,编码蛋白的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
[0200]
本领域的技术人员熟知的方法能用于构建含本发明蛋白编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。使用本发明的基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子。
[0201]
所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其他一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
[0202]
包括本发明基因、表达盒或的载体可以用于转化适当的宿主细胞,以使宿主表达蛋白质。宿主细胞可以是原核细胞,如大肠杆菌,链霉菌属、农杆菌;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如植物细胞。本领域一般技术人员都清楚如何选择适当的载体和宿主细胞。用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物(如大肠杆菌)时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
[0203]
转化植物也可使用农杆菌转化或基因枪转化等方法,例如叶盘法、幼胚转化法、花芽浸泡法等。对于转化的植物细胞、组织或器官可以用常规方法再生成植株,从而获得转基因的植物。
[0204]
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
[0205]
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0206]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、植物细胞(如水稻细胞)。
[0207]
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
[0208]
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0209]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0210]
本发明所述的蛋白可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0211]
改良植物的性状
[0212]
在本发明中,还提供了一种改良植物性状的方法,具体地,促进或提高pdc或其编码蛋白的表达,从而改良植物的性状,所述性状包括增强植物对细菌,比如青枯菌的抗性。
[0213]
农用组合物或制剂
[0214]
可将本发明的活性物质(如丙酮酸脱羧酶介导的代谢途径相关物质或pdc基因或其编码蛋白或其促进剂)以常规的方法制备成农用制剂,例如溶液剂、乳剂、混悬剂、粉剂、泡沫剂、糊剂、颗粒剂、气雾剂、用活性物质浸渍的天然的和合成的材料、在多聚物中的微胶囊、用于种子的包衣剂。
[0215]
这些制剂可用已知的方法生产,例如,将活性物质与扩充剂混合,这些扩充剂就是液体的或液化气的或固体的稀释剂或载体,并可任意选用表面活性剂即乳化剂和/或分散剂和/或泡沫形成剂。例如在用水作扩充剂时,有机溶剂也可用作助剂。
[0216]
用液体溶剂作稀释剂或载体时,基本上是合适的,如:芳香烃类,例如二甲苯,甲苯或烷基萘;氯化的芳香或氯化的脂肪烃类,例如氯苯,氯乙烯或二氯甲烷;脂肪烃类,例如环己烷或石蜡,例如矿物油馏分;醇类,例如乙醇或乙二醇以及它们的醚和脂类;酮类,例如丙酮,甲乙酮,甲基异丁基酮或环已酮;或不常用的极性溶剂,例如二甲基甲酰胺和二甲基亚砜,以及水。
[0217]
就液化气的稀释剂或载体说,指的是在常温常压下将成为气体的液体,例如气溶胶推进剂,如卤化的烃类以及丁烷,丙烷,氮气和二氧化碳。
[0218]
固体载体可用研磨的天然矿物质,例如高岭土,粘土,滑石,石英,活性白土,蒙脱土,或硅藻土,和研磨合成的矿物质,例如高度分散的硅酸,氧化铝和硅酸盐。供颗粒用的固体载体是碾碎的和分级的天然锆石,例如方解石,大理石,浮石,海泡石和白云石,以及无机和有机粗粉合成的颗粒,和有机材料例如锯木屑,椰子壳,玉米棒子和烟草梗的颗粒等。
[0219]
非离子的和阴离子的乳化列可用作乳化剂和/或泡沫形成剂。例如聚氧乙烯-脂肪酸酯类,聚氧乙烯-脂肪醇醚类,例如烷芳基聚乙二醇醚类,烷基磺酸酯类,烷基硫酸酯类,芳基磺酸酯类以及白蛋白水解产物。分散剂包括,例如木质素亚硫酸盐废液和甲基纤维素。
[0220]
在制剂中可以用粘合剂,例如羧甲基纤维素和以粉末,颗粒或乳液形式的天然和合成的多聚物,例如阿拉伯胶,聚乙烯基醇和聚乙烯醋酸酯。
[0221]
可以用着色剂例如无机染料,如氧化铁,氧化钻和普鲁士蓝;有机染料,如有机染料,如偶氮染料或金属钛菁染料;和用痕量营养剂,如铁,猛,硼,铜,钴,铝和锌的盐等。
[0222]
在本发明中,所述“农用制剂”通常是农用植物生长调节剂,其含有丙酮酸脱羧酶介导的代谢途径相关物质或pdc基因或其编码蛋白或其促进剂作为增强植物对细菌(如青枯菌)抗性的活性成分;以及农业上可接受的载体。
[0223]
如本文所用,所述“农业上可接受的载体”是用于将本发明的丙酮酸脱羧酶介导的代谢途径相关物质或pdc基因或其编码蛋白或其促进剂传送给植物的农药学上可接受的溶剂、悬浮剂或赋形剂。载体可以是液体或固体。适用于本发明的农业上可接受的载体选自下组:水、缓冲液、dmso、表面活性剂如tween-20、或其组合。任何本领域技术人员已知的农业上可接受的载体均可用于本发明中。
[0224]
本发明的农用制剂可与其他抗细菌的物质制成一种混合物存在于它们的商品制剂中或从这些制剂制备的使用剂型中,这些其他的抗细菌的物质包括(并不限于):青枯立克等。
[0225]
此外,本发明的农用制剂也可与增效剂制成一种混合物存在于它们的商品制剂中或从这些制剂制备的使用剂型中,这些增效剂是提高活性物质作用的化合物,由于活性物质本身有活性,也可不必加增效剂。
[0226]
本发明所述的农用制剂的剂型可以是多种多样的,只要能够使活性成分有效地到达植物体内的剂型都是可以的,从易于制备和施用的立场看,优选的农用制剂是一种喷雾剂或溶液制剂。
[0227]
本发明所述的农用制剂通常含有占所述农用制剂总重量的0.0001-99wt%,较佳地0.1-90wt%的本发明的活性物质。商品制剂或使用剂型中的本发明的活性物质的浓度可在广阔的范围内变动。商品制剂或使用剂型中的本发明化合物的浓度可从0.0000001-100%(g/v),最好在0.0001与1%(g/v)之间。
[0228]
增强植物细菌抗性的方法
[0229]
本发明提供了一种增强植物细菌抗性的方法,包括步骤:给植物丙酮酸脱羧酶介导的代谢途径相关物质,或施用相应的农用组合物或制剂,其中,所述丙酮酸脱羧酶介导的代谢途径相关物质选自下组:丙酮酸、乙酸、或其组合。
[0230]
施用可采用已知的各种方法,例如,通过在植物叶片、繁殖材料上喷洒、喷雾、喷粉或播撒该丙酮酸脱羧酶介导的代谢途径相关物质或含有该丙酮酸脱羧酶介导的代谢途径相关物质的农用组合物或制剂,或以其他方式使植物接触该丙酮酸脱羧酶介导的代谢途径相关物质或含有该丙酮酸脱羧酶介导的代谢途径相关物质的农用制剂,如果是种子,则通过涂布、包裹或以其他方式处理种子。另一种在种植前直接处理植物或种子的方法,还可将本发明的农用组合物或制剂引入土壤或其他待播种种子的培养基。在一些实施方案中,还可以使用载体,所述载体可以是如上所述的固态、液态。
[0231]
在一优选实施方式中,还可以通过喷洒(如飞机喷洒)或灌溉将该丙酮酸脱羧酶介导的代谢途径相关物质或含有该丙酮酸脱羧酶介导的代谢途径相关物质的农用组合物或制剂递送给所述植物。
[0232]
本发明的主要优点包括:
[0233]
(1)本发明首次发现,在低氧条件或丙酮酸脱羧酶介导的代谢途径相关物质存在下,增加植物中pdc基因的含量或上调表达该基因可改善植物的农艺性状,如增强植物对细菌,如青枯菌的抗性。
[0234]
(2)本发明首次证明了在低氧环境下,植物中由丙酮酸脱羧酶(pyruvate decarboxylase)介导的代谢途径被激活,从而提高植物的抗非生物胁迫能力(如抗旱能力)和抗生物胁迫能力(如抗细菌,比如抗青枯菌能力)。此外,若植物在遭遇短期洪涝灾害等可激活此代谢途径的情况下,植物的抗生物胁迫能力(如抗细菌,比如青枯菌能力)也会增强。
[0235]
(3)本发明的研究表明,对土壤进行一定浓度的丙酮酸或乙酸处理可以是一种简单有效的植物抗病措施,并且丙酮酸、乙酸对是易挥发、易被降解的小分子酸,土壤中的少量残留可迅速被清除,土壤质量可短期内迅速恢复。
[0236]
(4)本发明首次发现,丙酮酸脱羧酶介导的醋酸途径增强了植物(如番茄)对青枯菌的抗病性。
[0237]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条
件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非有特别说明,否则实施例中所用的材料、菌株和试剂均为市售产品。
[0238]
材料与方法:
[0239]
植物材料及菌株
[0240]
本研究所用拟南芥(arabitopsis thaliana)植株为哥伦比亚(col-0)背景。在1/2murashige和skoog(ms)固体培养基上萌发萌发,生长环境为23℃、光照16h/8h、相对湿度为70%的长日照培养箱。
[0241]
本研究所用番茄为solanum lycopersicum cv.moneymaker,生长环境为28℃、16h光照/8h黑暗、相对湿度为65%的长日照培育箱中。在土壤中萌发10d后,移栽番茄苗子至jiffy pot中,用有机酸处理后,接种青枯菌。接种青枯菌后,将植株转移到28℃、16h光照/8h黑暗、相对湿度为75%的长日照培育箱中。
[0242]
本研究所用菌株为发根农杆菌msu440菌株与青枯菌gmi1000。发根农杆菌用于在番茄根系的基因沉默,在28℃添加相应浓度抗生素的固体lb培养基上培养2天后,然后用于接种到切掉根的番茄植株上。青枯菌gmi1000用于侵染植物,在固体phi培养基上培养2天后,于添加适量抗生素的phi液体培养基中28℃过夜培养。
[0243]
青枯菌接种
[0244]
本研究用于青枯菌侵染的番茄为3.5周龄植株(每个基因型至少12株),采用土淋接种方法。用浓度为108cfu ml-1的细菌悬浮液浸渍植株。每株植物用30ml菌液悬浮液侵染,孵育20分钟后,将植物jiffy pot转移到铺有混合土床的新托盘中(vailleau et al.,2007)。如前所述,从
‘0’
(无症状)到
‘4’
(完全枯萎)的等级对植株疾病症状进行评分(vailleau et al.,2007)c。对于存活率数据分析,将疾病评分转换成具有如下标准的二进制数据:对于每个特定时间点(dpi),疾病指数小于2被定义为“0”,而等于或大于2的疾病指数被定义为“1”(remigi et al.,2011)。
[0245]
对于测定细菌接种后植物组织中丙酮酸脱羧酶活性,拟南芥幼苗在1/2ms固体培养基上培养一周后,用5μl含105cfu ml-1青枯菌悬液接种在每株幼苗的根尖上。采集1、2或3dpi的幼苗用于测量丙酮酸脱羧酶活性。对于番茄茎注射青枯菌接种番茄,并于3dpi截取植株茎段组织样品用于检测丙酮酸脱羧酶活性。
[0246]
构建番茄基因沉默植株
[0247]
为了构建slpdc2 rnai载体,从番茄的cdna中扩增一段204bp长度的slpdc2(solyc02g077240)片段。所用引物如下
[0248]
正向:caccatgctattgctgggggcatacagtg(seq id no.:5);
[0249]
反向:tatcaatcaattcatgggcatc(seq id no.:6)
[0250]
克隆此片段基因到pentr-d/topo载体上,然后亚克隆到表达载体pk7gwiwg2_ii-redroot(http://gateway.psb.ugent.be).slpdc2克隆片段分别与其他slpdc同源基因solyc09g005110、solyc06g082130和solyc10g076510的相应片段有81%、81%和84%的同源性。转基因根番茄植株的构建如前所述(morcillo et al.,2020)。切下番茄幼苗的胚根,并将得到的下胚轴浸泡在含有pk7gwiwg2_ii-redroot::slpdc2或pk7gwiwg2_ii-redroot的发根农杆菌msu440中(pk7gwiwg2_ii-redroot为对照)。培育幼苗以允许转基因根的萌发
生长并切除多余非转基因的根。转化3周后,将幼苗移入jiffy pot,3~4周后如上所述进行青枯病菌(od600为0.1)的淋土接种。症状评分如上所述。
[0251]
rna提取和rt-pcr定量
[0252]
将用于提取rna植物组织放入2ml含1个金属珠的ep管中,立即放入液氮中,并于-80℃冰箱中冻存。用组织研磨仪研磨1分钟,然后放回液氮中。依据使用手册,用e.z.n.a.植物rna试剂盒(biotek,中国)提取总rna,无需dna消化。rna样品用纳米滴分光光度计(美国thermofisher)定量后,用iscript gdna clear cdna合成试剂盒(bio-rad)合成第一链cdna。使用itaqtm universal sybr green supermix(bio-rad,美国)和cfx96实时系统(bio-rad,美国)进行定量检测。
[0253]
用于检测相应基因表达的为
[0254]
slpdc正向:ctccaaaggtcagcaatcaa(seq id no.:7),
[0255]
slpdc反向:cctttgtgcttttcccact(seq id no.:8);
[0256]
slef1正向:ggtgcgagcatgatttga(seq id no.:9),
[0257]
slef1反向:cgagccaaccatggaaaacaa(seq id no.:10)。
[0258]
atpdc2正向:gcttatctgtttgcaggtccg(seq id no.:11),
[0259]
atpdc2反向:aacacatccaaacgcaggtc(seq id no.:12);
[0260]
atactin正向:ctaagctctcaagatcaaaggctt(seq id no.:13),
[0261]
atactin反向:actaaaacgcaaaacgaaagcggtt(seq id no.:14)。
[0262]
pdc活性测量
[0263]
pdc活性按boeckx描述的方式确定(boeckx et al.,2017)。将植物组织冻存于含1个金属株的2ml ep管中,于低温下用组织研磨仪研磨后,溶于100mm 2-(n-morpholino)ethane sulfonic acid(mes)缓冲液(ph7.5)、5mm二硫苏糖醇(dtt)、2.5%(w/v)聚乙烯吡咯烷酮(pvp)和0.02%(w/v)triton x-100的提取缓冲液中。对于研磨好的植物组织,使用3:1(v/w)的比例提取植物组织中总蛋白。植物粗提物在4℃孵育15min后16000g离心20min。然后,将50μl的上清液加入150μl的酶分析缓冲液中。酶活分析缓冲液包含10mm mes缓冲液(ph6.5)、10μl 50μm硫胺素焦磷酸钠、50mm氯化镁、50units乙醇脱氢酶溶液(美国sigma)、50mm丙酮酸钠和0.8mm nadh(中国伊森)。将样品和缓冲液混合在96孔透明板中,每个样品进行8次技术重复,使用varioskan多功能酶标仪(thermofisher,德国)在37℃连续记录340nm下吸光度的下降,90分钟(每分钟1次测量)测量nadh的氧化。通常,在90分钟内,nadh的下降通常达到一个稳定的基础水平。使用与boeckx描述的曲线的线性部分相对应的数据计算酶活性(vailleau et al.,2007)。
[0264]
有机酸的处理
[0265]
有机酸处理总体如前所述(kim et al.,2017),本研究中做了一些修改。简言之,用30mm的丙酮酸、乙酸或甲酸溶液对2周龄番茄植株进行预处理,每天每株10ml,连续处理9天。通过用有机酸浸泡位于jiffy pot下面的纸巾有机酸就会被毛细作用吸收。9天后,在不破坏根部的情况下,用水轻轻冲洗jiffy pot几次,以去除土壤中的残留酸,正常生长3天后,接种青枯菌。
[0266]
统计分析
[0267]
用prism 7.0软件(graphpad)进行统计分析。数据以平均值
±
sem展示。图例标注
legume plant medicago truncatula.molecular plant-microbe 20(2),159-167.doi:10.1094/mpmi-20-2-0159.
[0280]
2.remigi,p.,anisimova,m.,guidot,a.,genin,s.,and peeters,n.(2011).functional diversification of the gala type iii effector family contributes to ralstonia solanacearum adaptation on different plant hosts.new phytologist.192(4),976-987.doi:10.1111/j.1469-8137.2011.03854.x.
[0281]
3.morcillo,r.j.l.,zhao,a.,tamayo-navarrete,m.i.,garc
í
a-garrido,j.m.,and macho,a.p.(2020).tomato root transformation followed by inoculation with ralstonia solanacearum for straightforward genetic analysis of bacterial wilt disease.jove.(157),e60302.doi:doi:10.3791/60302.
[0282]
4.boeckx,j.,hertog,m.,geeraerd,a.,and nicolai,b.(2017).kinetic modelling:an integrated approach to analyze enzyme activity assays.plant methods.13(1),69.doi:10.1186/s13007-017-0218-y.
[0283]
5.kim,j.-m.,to,t.k.,matsui,a.,tanoi,k.,kobayashi,n.i.,matsuda,f.,habu,y.,ogawa,d.,sakamoto,t.,matsunaga,s.,et al.(2017).acetate-mediated novel survival strategy against drought in plants.nature plants.3(7),17097.doi:10.1038/nplants.2017.97.
[0284]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
