cxcl5抑制剂在制备治疗肿瘤的药物中的应用
技术领域
1.本发明涉及肿瘤药物领域,具体涉及cxcl5抑制剂在制备治疗肿瘤的药物中的应用。
背景技术:
2.肿瘤是在各种致癌因子的作用下局部组织异常增生所形成的新生物,分为良性肿瘤和恶性肿瘤,其中,恶性肿瘤严重危害人们的身体健康,其所带来的医疗费用负担及对患者和亲属产生的心里压力也是巨大的。许多肿瘤的发生机制极其复杂,导致肿瘤的临床治疗中也常常面临一些问题,例如肿瘤在免疫治疗过程中产生的耐药性,会降低肿瘤对药物的敏感性的同时也导致肿瘤细胞的增殖,这给肿瘤的有效治疗带来了一定的挑战。
技术实现要素:
3.本发明提供了cxcl5抑制剂在制备治疗肿瘤的药物中的应用,把cxcl5抑制剂用于制备治疗肿瘤的药物,能够有效改善肿瘤的耐药性,增加肿瘤对药物的敏感性,对肿瘤的临床治疗具有重要的意义。
4.根据本发明的一个方面,提供cxcl5抑制剂在制备治疗肿瘤的药物中的应用。
5.cxcl5是肿瘤相关巨噬细胞(tumor-associated macro-phages,tams)分泌的细胞因子之一,cxcl5的分泌增加会异常激活多条致癌信号通路,从而导致肿瘤在免疫治疗的过程中产生耐药性,显著降低肿瘤对药物的敏感性。本发明把cxcl5抑制剂应用于治疗肿瘤的药物的制备中,cxcl5抑制剂能够与cxcl5细胞因子结合,有效地抑制了肿瘤组织中cxcl5细胞因子的功能,改善肿瘤免疫治疗过程中产生的耐药性,增加肿瘤治疗过程中对药物的敏感性,进而提高肿瘤治疗效果。
6.优选地,肿瘤为非霍奇金淋巴瘤。非霍奇金淋巴瘤具有极强的异质性,更容易发生转移,这种异质性使得治疗肿瘤的药物只能选择性地杀伤一部分肿瘤细胞,而存活下来的肿瘤细胞逐渐从原来在肿瘤组织中的小部分变成了主体,即对药物产生耐受性。本发明把cxcl5抑制剂应用于制备治疗肿瘤的药物,能够改善这种耐药性。
7.优选地,非霍奇金淋巴瘤为套细胞淋巴瘤。
8.优选地,cxcl5抑制剂为cxcl5中和抗体。cxcl5中和抗体能够与tams分泌的cxcl5细胞因子结合,抑制肿瘤组织中cxcl5的功能,增加肿瘤对药物的敏感性,提高肿瘤治疗效果。
9.优选地,采用btk抑制剂与cxcl5抑制剂配合使用。
10.btk抑制剂主要通过抑制肿瘤中异常激活的btk信号通路来抑制肿瘤细胞的增殖,但长时间使用btk抑制剂会导致肿瘤细胞对btk抑制剂产生耐药性。本方案采用btk抑制剂与cxcl5抑制剂配合使用,btk抑制剂能够抑制肿瘤细胞增殖,而cxcl5抑制剂能够提高肿瘤细胞对btk抑制剂的敏感性,进而改善肿瘤细胞对btk抑制剂的耐药性,提高肿瘤治疗效果。
11.优选地,btk抑制剂为伊布替尼。
ficoll溶液,向其中缓慢加入5ml上述稀释后的血液,1500rpm离心15min。经过离心后,离心管中的内容物分为三层,上层为血浆(内含细胞碎片),中间层为分层液,底层为红细胞,在上、中层液体界面处可以观察到乳白混浊的单核细胞层(较薄的白膜层),吸弃上清至白膜层上2-3mm处,将白膜层转移至干净的15ml离心管中,向其中加入10ml pbs缓冲液,1000rpm离心10min,利用pbs缓冲液重复清洗2次。随后用pbs缓冲液重悬细胞,于显微镜下计数。根据计数结果,每1
×
107个细胞用80μl pbs缓冲液进行重悬,并加入20μl可以吸附cd14
+
单核细胞的磁珠(130-050-201,美天旎,德国),于冰上孵育15min,然后用1-2ml pbs缓冲液清洗一次,再重悬细胞至3ml。将得到的重悬液加入ls分选柱(130-093-545,美天旎,德国),洗两次,将磁极(130-042-301,美天旎,德国)从分选柱上拿下,并用pbs缓冲液将目的细胞冲洗下来,计数后,1500rpm离心10min,用含有人巨噬细胞集落刺激因子(macrophage-colony stimulating factor,m-csf,150ng/ml,peprotech,rocky hill,nj)的培养基进行重悬,种板,得到人源巨噬细胞。
33.实施例3
34.将实施例1得到的mino细胞系(mcl细胞)与实施例2得到的人源巨噬细胞进行共培养,利用细胞因子芯片技术对共培养前后mcl细胞上清液中细胞因子浓度变化进行检测,结果如图1所示。由图1可知,g-csf、ccl5、il-8和mcp-1是共培养前后mcl细胞上清液中变化最明显的四种细胞因子。
35.随后,利用elisa实验检测这四种细胞因子随时间的动态改变,结果如图2所示。由图2可知,在上述四种细胞因子中,g-csf细胞因子的浓度随时间的增加最为明显。
36.实施例4
37.将实施例1中得到的mino细胞系(mcl细胞)与人源巨噬细胞进行共培养,利用细胞因子芯片技术对共培养前后巨噬细胞上清液中细胞因子浓度变化进行检测,结果如图3所示。由图3可知,cxcl5、ccl5、ccl3和cxcl1是共培养前后巨噬细胞上清液中变化最明显的四种细胞因子。
38.随后,利用elisa实验检测这四种细胞因子随时间的动态改变,结果如图4所示。由图4可知,在上述四种细胞因子中,cxcl5细胞因子的浓度随时间的增加最为明显。
39.实施例5
40.为了明确mcl细胞分泌的g-csf细胞因子对巨噬细胞的表型变化的影响,向含有巨噬细胞的培养基中加入g-csf,并利用流式细胞技术对巨噬细胞的表型进行检测,并以il-13+il-14作为诱导巨噬细胞向m2型极化的阳性对照(il-13+il-14组),以ifn-γ作为诱导巨噬细胞向m1型极化的阳性对照(ifn-γ组),以igg作为阴性对照(g-csf+igg组),m2型巨噬细胞与m1型巨噬细胞的比值结果如图5所示。由图5可知,加入g-csf后,m2型巨噬细胞的比例显著增加(g-csf组),其促极化效果与il-13+il-14组相当,而加入g-csf中和抗体之后(g-csf+g-csf中和抗体组),m2型巨噬细胞与m1型巨噬细胞的比值与未加入任何细胞因子的对照组相当。综上所述,mcl细胞与巨噬细胞共培养后高分泌的g-csf可以促使巨噬细胞向m2型极化。
41.实施例6
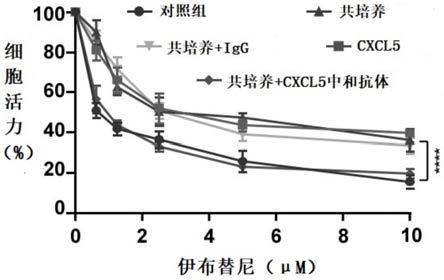
42.通过cck-8实验检测巨噬细胞分泌的cxcl5细胞因子是否会降低伊布替尼对mcl细胞的抑制作用,结果如图6所示。其中,对照组为仅含mcl细胞的培养体系,共培养组为含有
mcl细胞和巨噬细胞的共培养体系,共培养+igg组为在mcl细胞和巨噬细胞的共培养体系中加入igg,cxcl5组表示在mcl细胞培养体系中加入cxcl5细胞因子,共培养+cxcl5中和抗体组表示在mcl细胞和巨噬细胞的共培养体系中加入cxcl5中和抗体。由图6的cck-8实验结果可知,共培养组和cxcl5组的mcl细胞活力显著高于对照组的细胞活力,在共培养体系中加入cxcl5中和抗体(共培养+cxcl5中和抗体组)能够显著降低mcl细胞的细胞活力,这表明cxcl5会降低伊布替尼对mcl细胞的抑制作用,而cxcl5中和抗体的加入则能够提高伊布替尼对共培养体系中的mcl细胞的抑制效果。
43.实施例7
44.将mino细胞(5
×
106/μl)与人源巨噬细胞(5
×
106/μl)按照1:1的比例进行混合得到细胞悬液,注射到nod/scid小鼠腹侧皮下组织,待形成可评估的皮下肿瘤后,其中三组小鼠进行伊布替尼灌胃并分别接受g-csf中和抗体、cxcl5中和抗体、g-csf中和抗体+cxcl5中和抗体处理,分别记为共培养+g-csf中和抗体+伊布替尼组、共培养+cxcl5中和抗体+伊布替尼组、共培养+g-csf中和抗体+cxcl5中和抗体+伊布替尼组,其中一组小鼠接受igg处理作为对照组(共培养+igg+伊布替尼组),在并记录皮下瘤体积随时间的动态变化,结果如图7所示。结果显示,共培养+cxcl5中和抗体+伊布替尼组的皮下瘤体积是共培养+igg+伊布替尼组皮下瘤体积的17.6%,共培养+g-csf中和抗体+伊布替尼组的皮下瘤体积是共培养+igg+伊布替尼组皮下瘤体积的14.8%,而共培养+g-csf中和抗体+cxcl5中和抗体+伊布替尼组的皮下瘤体积是共培养+igg+伊布替尼组皮下瘤体积的11.8%。以上研究结果证明,g-csf中和抗体和cxcl5中和抗体均能显著抑制mcl细胞在小鼠体内的增殖,但g-csf中和抗体和cxcl5中和抗体的联合使用并没有表现出明显的协同抗肿瘤作用。
45.实施例8
46.基于实施例7的结果,猜测cxcl5和g-csf之间可能存在相互调节的关系,因此在体外对经g-csf处理后的巨噬细胞上清液中cxcl5浓度变化和经cxcl5处理后的mcl细胞上清液中g-csf浓度变化进行检测,结果如图8所示。由图8可知,外源性加入g-csf会促进巨噬细胞分泌cxcl5,而外源性加入cxcl5则会抑制mcl细胞分泌g-csf。
47.综上所述,tams分泌的cxcl5会诱导mcl对伊布替尼产生耐药性,而cxcl5抑制剂(如cxcl5中和抗体)则能够与cxcl5结合,抑制cxcl5在肿瘤中的功能,进而降低mcl细胞对伊布替尼的耐药性,增加mcl细胞对伊布替尼的敏感性。因此,cxcl5抑制剂能够应用于治疗肿瘤的药物的制备中,这对肿瘤的临床治疗意义重大。
48.以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,但这些修改或替换均在本发明的保护范围之内。
