包含稳定rna治疗剂的外泌体
技术领域
1.本发明涉及细胞外囊泡(ev)治疗剂(其中,所述ev包含通过内源方式加载的稳定核酸、多肽以及用于将此类稳定核酸通过内源方式加载至ev中的多核苷酸构建体);所述ev的产生方法;经工程化改造产生所述ev的细胞以及所述ev在医学中的应用。
背景技术:
2.核酸(na)治疗剂正迅速用于各种临床应用。基因替代疗法、mrna疗法、短寡核苷酸和sirna治疗剂只是rna治疗剂领域内众多形式中的几个示例。裸核酸(通常为mrna)由于清除速度快、具有核酸酶活性、缺少器官特异性分布以及细胞摄取效率低,很难在体内输送,因此通常需要采用专用输送载体作为实现生物活性输送的必要手段。对于非肝靶点和高分子量rna治疗剂(如mrna治疗剂)来说尤其如此。
3.细胞外囊泡(如外泌体)通常为各类细胞产生的纳米级囊泡,其将作为人体细胞间蛋白、核酸、肽、脂质和各种其他分子的天然运输系统。含rna的ev具有多种潜在的治疗用途,并且ev已被研究用作mrna、sirna治疗剂以及各种环境下其他短核酸药物的输送载体。wo2010/119256代表了使用外泌体的核酸输送领域的基础发明,所述发明描述了外泌体在输送几种核酸内容物方面的效用。pct/gb2017/051479描述了借助rna结合蛋白通过内源方式加载各种rna治疗剂的改进方法,将目标rna拖入亲本细胞内形成的ev中。us14/502,494代表了另一种利用rna结合蛋白加载某些种类rna(即利用所谓的靶向和模块化外泌体加载(tamel)系统)的方法。
4.然而,尽管取得了这些进步,但在本领域中仍存在巨大的发展空间,即采用特定、高效的方式将较大和较小na内容物加载到ev中。此外,所有输送系统的一个关键方面在于将生物活性物质实际输送到靶细胞,而现有技术在这方面也有改进的空间。此外,所有na输送技术均存在某些问题,例如核酸(尤其是mrna)被输送到受体细胞后半衰期相对较短、易变,na治疗剂在生产和储存期间半衰期较短。
5.us14/502,494及相应参考文献(hung和leonard,《细胞外囊泡杂志》,2016年,5:31027)中所述的tamel加载系统存在很多缺点,而本发明则试图克服这些缺点。tamel系统的主要缺点在于无法实现mrna的功能性输送,即,当细胞接触外泌体时,细胞不会对通过tamel系统加载到外泌体中的mrna进行翻译。本技术实现了内容物na的生物活性输送。
6.tutucci等人(一种准确报告mrna生命周期的改进ms2系统。《自然方法》。2018年1月;15(1):81-89)讨论了ms2蛋白在rna定位及生命周期研究中的应用前景,并表明tamel系统ms2蛋白以很高的亲和性与rna结合。本文认为,这种紧密结合会对mrna调节研究造成问题。我们推测,在ev加载时,因为靶rna与ms2的紧密结合意味着不会释放所加载的任何rna,所以此类高亲和性结合会造成其他的问题。阻止释放mrna,将会阻止正常翻译,这就解释了为什么在us14/502,494中没有观察到mrna翻译。
7.tamel系统似乎并未向所有外泌体加载核酸,而已加载核酸的外泌体也只加载了极少量的核酸(下文详细讨论了这种易变、低水平加载的缺点)。这些易变、低水平加载结合
以下事实,即核酸加载非常少,几乎无法进行释放,因此不具有生物活性,并且由于天然mrna不稳定,所释放的核酸寿命很短,这意味着tamel系统存在很多缺陷。tamel系统不适合于加载和输送临床相关量的生物活性核酸。本发明克服了这些重大缺点。
8.tamel系统的另一项缺陷在于其使用噬菌体蛋白,在将所生产的ev输送给患者时,噬菌体蛋白可能会引起不良免疫反应。本发明也克服了这一缺点。
技术实现要素:
9.因此,本发明的一个目的在于克服上述与生物活性na治疗剂加载以及随后ev介导输送相关的问题,并满足当前在该领域内的需求,例如,使完整、高度稳定的na治疗剂到达正确的细胞内区室。
10.本发明通过利用新的ev工程化改造技术加载并释放稳定na(核酸)内容物(优选mrna内容物)来实现这一目的。
11.实现方式为采用肽和多核苷酸构建体的高级工程化改造技术以及产生细胞的工程化改造技术,确保na不仅能够被高效加载到ev中,而且na在产生、加载和输送过程中均具有高度稳定性,并且所考虑的na能够被有效释放。
12.在第一方面,本发明涉及一种细胞外囊泡(ev),所述细胞外囊泡包含至少一个polya结合蛋白(pabp)或其一个片段或结构域以及至少一个na内容物分子(包含一段连续腺嘌呤核苷酸(即一个polya区或polya尾))。
13.有利的是,本发明的ev可进一步包含至少一个融合多肽(包含至少一个核酸(na)结合结构域和至少一个外泌体多肽),其中,所述融合多肽可包含pabp。在本实施例中,通过融合蛋白将na运输到ev中。有利的是,所述ev可进一步包含至少一个靶向部分。
14.本发明还涉及一种本发明所述ev的群体。有利的是,所述ev群体中的每个ev包含至少一个na内容物分子,和/或ev群体中最多95%包含一个na内容物分子。
15.本发明还涉及一种本发明所述ev的生产方法,所述方法包括:将至少一个编码pabp蛋白或其一个片段或结构域的多核苷酸构建体引入ev产生细胞中;将至少一个编码至少一个na内容物分子(包含一个polya区)的多核苷酸构建体引入相同的ev产生细胞中;以及在所述ev产生细胞中表达pabp和na内容物分子,从而产生所述ev。有利的是,所述方法进一步包括:将至少一个编码融合多肽(包含至少一个na结合结构域和至少一个外泌体多肽)的多核苷酸构建体以及至少一个编码翻译起始因子的多核苷酸构建体(可选)引入ev产生细胞中;在所述ev产生细胞中表达至少一个由多核苷酸构建体编码的多肽构建体,从而产生所述ev。在其他有利方面,在本发明的方法中,所述pabp蛋白或其片段或结构域形成融合多肽(包含至少一个na结合结构域和至少一个外泌体多肽)的一部分。
16.在另一方面,本发明涉及一种细胞,所述细胞包含:至少一个编码polya结合蛋白(pabp)的多核苷酸构建体;至少一个编码na内容物分子的多核苷酸构建体;以及包含至少一个na结合结构域和至少一个外泌体多肽的融合蛋白,其中,所述融合蛋白可包含pabp。
17.在另一方面,本发明涉及一种细胞内输送至少一个na内容物分子的体外方法,包括使靶细胞与本发明所述的至少一种ev和/或本发明所述的至少一种ev群体发生接触。
18.本发明还涉及一种药物合成物,所述药物合成物包含(i)本发明所述的至少一种ev;(ii)本发明所述的至少一种细胞;和/或(iii)本发明所述的至少一种ev群体;以及一种
可药用赋形剂或载体。
19.在另一方面,本发明还涉及本发明所述的至少一种:ev、细胞、ev群体和/或药物合成物(药用)。
附图说明
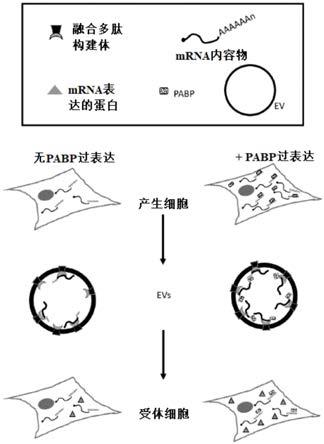
20.图1:示意图,显示了在pabp过表达或未过表达的情况下表达融合蛋白构建体的产生细胞、产生细胞在使用本发明所述的融合多肽构建体加载na内容物分子(有或没有结合并稳定na内容物polya片段的pabp)后产生的ev、接受所述ev的受体细胞和na内容物表达的蛋白。
21.图2:柱状图,显示了使用融合多肽构建体将编码nanoluc(rtm)和p21的na内容物分子加载到msc衍生ev中,其中,所述融合多肽构建体包含外泌体多肽cd63和na结合结构域puf(在这种情况下,na结合puf结构域从人pum1蛋白中获得)或cas6。实验还包括na结合结构域中不同数量的结合位点,即0个、3个和6个结合位点。单独外泌体多肽cd63的表达不会产生ev加载mrna的结果(右)。包含puf的融合多肽的表达(左列:cd63的n端和c端分别侧接有两个puf结构域,即共4个puf构建体)(左起第二列:cd63的n端和c端分别侧接有一个puf结构域)和突变的cas6(右起第二列)在ev源细胞中表达时产生nanoluc(rtm)和p21 mrna显著加载的结果。总体上,加载nanoluc(rtm)比加载p21更为有效,每个ev最多可加载约45个mrna复制体。
22.图3:柱状图,显示了在nanoluc(rtm)mrna进行hek ev介导输送后,nanoluc(rtm)在靶hela细胞中作为报告系统的表达情况。nanoluc(rtm)mrna内容物分子经工程化改造,包含na结合结构域(包含融合多肽构建体)的0个、3个或6个结合位点,在这种情况下,包括pufx2-cd63-pufx2(外泌体多肽cd63的n端和c端分别插入两个puf na结合多肽)、puf-cd63-puf和cas6-cd9-cas6。y轴显示了根据μg蛋白归一化的相对光(发光)单位(rlu),表明随着结合位点数量的增加,输送和/或翻译增强。在此分析中,还对人pum1以及从黑腹果蝇pumilio蛋白中获得的na结合puf进行了评估。
23.图4:pabp主要细胞功能的示意图。pabp主要功能示意图。(a)pabp与防止其脱腺苷化及随后降解的mrna分子的polya尾产生相互作用。(b)pabp与mrna分子的polya尾以及elf4g(一种翻译起始因子)产生相互作用,从而形成翻译起始复合物。
24.图5a和图5b:蛋白免疫印迹法,显示了在稳定表达nanoluc mrna的hek293t细胞中表达瞬时转染ha-pabp和cd63-pufeng,这两种蛋白也存在于条件培养基纯化的细胞外囊泡中。
25.图6:表格,显示了通过pabp在产生细胞中的过表达来增加加载到ev中的分子数量,每个ev中mrna分子的百分比增加量。
26.图7:柱状图,显示了存在pabp时,向huh7受体细胞输送的nanoluc mrna分子数量更多,并且因所输送mrna分子的翻译增加从而使细胞裂解液中检测到的rlu增加。
27.图8:柱状图,显示了在10倍稀释下重复进行图7所示摄取实验的结果。稀释后,可以更清楚地区分mrna的表达水平。存在pabp时,向huh7受体细胞输送的nanoluc mrna分子数量更多,并且因所输送mrna分子的翻译增加从而使细胞裂解液中检测到的rlu增加(7倍)。
具体实施方式
28.本发明涉及使用在体外和/或体内以生物活性形式引入、稳定na内容物并将其输送到靶细胞的新工程化改造方法改进稳定性、加载和受控释放过程,从而增强ev输送na治疗剂的疗效。
29.为方便和清晰起见,下文收集并说明了本文所用的某些术语。除非另有定义,否则本文所用的所有技术和科学术语均具有本发明所属领域普通技术人员公知的相同含义。
30.当根据马库什组来描述本发明的特征、方面、实施例或替代方案时,本领域技术人员将认识到,还可根据马库什组要素的任何单独要素或子组来描述本发明。本领域技术人员将进一步认识到,还可根据马库什组要素的单独要素或子组的任何组合来描述本发明。此外,应注意,结合本发明的一个方面和/或实施例描述的实施例和特征对细节做出必要修改后也适用于本发明的所有其他方面和/或实施例。例如,本文所述的与ev相关的pabp和转录起始因子蛋白以及融合多肽应理解为已公开、相关并与本文所有其他方面、教导和实施例兼容(例如,与ev产生方法相关的方面和/或实施例)或与本文所述的相应多核苷酸构建体或衍生ev的工程化改造ev产生细胞相关。此外,结合某些方面描述的某些实施例,例如包含na药物内容物分子和融合多肽(可选)的ev的给药途径(如涉及与治疗某些医学适应症有关的方面所述),也可与其他方面和/或实施例存在自然的关联,如与包含此类ev的药物合成物有关的方面和/或实施例。此外,可利用常规多肽融合策略,将本文确定的所有多肽和蛋白自由地结合在融合蛋白中。作为非限制性示例,本文所述的na结合结构域(属于多肽来源)可与一种或多种外泌体多肽以任何组合形式自由结合,可选地与本文的所有其他多肽结构域、区域、序列、肽、基团结合,例如,任何多聚化结构域、释放结构域和/或靶向肽。同样,外泌体多肽和/或na结合结构域可以彼此结合,产生包含多于一个外泌体多肽和/或多于一个na结合结构域的构建体。此外,此类融合蛋白可包含pabp和/或转录起始因子蛋白,例如,在一个非限制性示例中,在外泌体蛋白、na结合结构域和pabp之间形成融合蛋白,可选地另外包含转录起始因子。此外,任何及所有特征(例如马库什组的任何及所有成员)可以与任何及所有其他特征(例如任何其他马库什组的任何及所有成员)自由结合,例如,任何na结合结构域(和/或通常从此类na结合结构域中获得的任何na结合蛋白)可与任何外泌体多肽结合。此外,当本文的教导将ev视为单个和/或将ev称为离散的天然纳米颗粒样囊泡时,应理解,所有此类教导均同等地与多个ev和ev群体相关并适用于它们。一般而言,本发明所述的na结合结构域、外泌体多肽、ev产生细胞来源、其他结构域和肽、na内容物分子以及所有其他方面、实施例和替代方案均可在不脱离本发明的范围和主旨的情况下以任何及所有可能组合形式自由结合。此外,在任何给定分子可实现与之相关的理想技术效果,本发明所涉及的任何多肽或多核苷酸或任何多肽或多核苷酸序列(分别为氨基酸序列或核苷酸序列)均可与原始多肽、多核苷酸和序列发生较大偏差。只要保持其生物学特性,本技术所述的多肽和/或多核苷酸序列与天然序列的偏差可高达50%(例如,使用blast或clustalw计算),但优选尽可能高的序列一致性或相似性(例如,60%、70%、80%、90%或更高)。本领域的标准方法可用于确定同源性。例如,uwgcg包提供了bestfit程序,可用于计算同源性,例如,用于其默认设置(devereux等人(1984年),《核酸研究》第12期,第387-395页)。例如,如altschul s.f.(1993年)《分子进化杂志》36:290-300;altschul,s.f等人(1990年)《分子生物学杂志》215:403-10所述,pileup和blast算法可用于计算同源性或排列序列(如识别
当量残基或响应序列(通常用于其默认设置))。例如,一些多肽的结合(融合)意味着可替换和/或修饰和/或可以通过插入其他氨基酸片段来中断相应多肽的某些片段,这意味着只要保留关键特性(例如,na结合、转运到ev中、靶向功能等),可产生与天然序列之间的较大偏差。因此,类似推理也适用于编码此类多肽的多核苷酸序列。本文提及的与肽、多肽和蛋白有关的任何登录号或seq id no仅应视为示例,仅供参考,并且所有肽、多肽和蛋白均应具有本领域的技术人员所理解的普通含义。因此,如上所述,本领域的技术人员还将理解,本发明不仅涵盖本文所指的特定seq id no和/或登录号,而且还涵盖其变体和衍生物。本文所指的所有登录号均为uniprotkb登录号,并且本文所提及的所有蛋白、多肽、肽、核苷酸和多核苷酸均应根据技术人员所理解的其常规含义来解释。
31.术语“细胞外囊泡”、“ev”、“外泌体”、“基因修饰/基因工程化改造外泌体”或“修饰外泌体”在本文中可互换使用,并且应理解为涉及可从细胞中以任何形式获得的任何类型的囊泡,例如微囊泡(如从细胞质膜脱落的任何囊泡)、外泌体(如由内体、溶酶体和/或内溶酶体途径衍生的任何囊泡)、凋亡小体、armm(如含抑制蛋白结构域的蛋白1[arrdc1]介导微囊泡)、微粒及其他囊泡结构。术语“基因修饰”和“基因工程化改造”ev表示ev由基因修饰/工程化改造细胞衍生而来,所述细胞通常包含重组或外源性na和/或融入这些细胞所产生的ev中的蛋白产物。术语“修饰ev”表示已使用基因或化学方法对囊泡进行修饰,例如,通过ev产生细胞的基因工程化改造,或通过化学共轭,例如使各部分附着于外泌体表面。ev大小可存在显著差异,但是,ev通常具有纳米级流体动力学直径,即直径小于1000nm。显然,ev可由体内、离体和体外的任何细胞类型衍生而来。首选ev包括外泌体和微囊泡,但是,在不同情况下,其他ev也可能有利。此外,所述术语还应理解为涉及细胞外囊泡模拟物、通过膜挤出、超声处理或其他技术获得的细胞膜囊泡。本领域的技术人员明白,当描述ev的医学和科学用途及应用时,本发明通常涉及多个ev,即,可包含数千个、数百万个、数十亿个或甚至数万亿个ev的ev群体。可从以下实验中得知,ev可以每单位体积(如每毫升)105、108、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
、10
18
、10
25
、10
30
个ev(通常称为“颗粒”)或更大、更小或介于两者之间的任何其他数值的浓度存在。同样,术语“群体”应理解为涵盖构成此群体的多个实体,可涉及包含一个na内容物分子(如一个mrna)的ev或包含外泌体多肽和na结合结构域之间的某种融合多肽的ev,所述融合多肽进而可结合目标na内容物分子。换句话说,当存在多个单个的ev时,构成ev群体。因此,自然地,本领域的技术人员明白,本发明既涉及单个的ev,也涉及包含ev的群体。在体内应用时,根据待治疗的疾病、给药途径、na内容物分子的治疗活性、效果和效力、ev上存在的任何靶向部分、药物制剂等,ev的剂量可自然地存在较大差异。此外,本发明的ev还可包含除na内容物分子之外的其他治疗剂。在一些实施例中,所述其他治疗剂至少可能是一种治疗性小分子药物。在一些实施例中,可从包括以下几项的一组中选择所述治疗性小分子药物:dna损伤剂、dna合成抑制剂、微管和微管蛋白结合剂、抗代谢物、氧化损伤诱导剂、抗血管生成剂、内分泌治疗剂、抗雌激素、免疫调节剂(如toll样受体激动剂或拮抗剂)、组蛋白去乙酰化酶抑制剂、信号转导抑制剂(如激酶抑制剂)、热休克蛋白抑制剂、类维生素a、生长因子受体抑制剂、抗有丝分裂化合物、抗炎剂、细胞周期调节剂、转录因子抑制剂和细胞凋亡诱导剂及其任何组合。在其他实施例中,所述其他治疗剂可以是其他na治疗剂。可以从包括以下几项的一组中选择此类其他核酸治疗剂:单链rna或dna、双链rna或dna、寡核苷酸(如sirna)、剪接转换rna、crispr引导链、短发夹rna(shrna)、
mirna、环二核苷酸、反义寡核苷酸、多核苷酸(如mrna)、质粒或任何其他rna或dna载体。化学合成和/或包含化学修饰核苷酸(如2'-o-me、2'-o-allyl、2'-o-moe、2'-f、2'-ce、2'-ea 2'-fana、lna、clna、ena、pna、硫代磷酸酯、三环dna等)的核酸制剂特别值得关注。在其他实施例中,本发明所述的ev可包含可以是蛋白和/或肽的其他治疗剂。此类蛋白和/或肽可存在于ev内部、插入ev膜中或与ev膜结合,或者可从ev突出到囊泡外环境中。可从一组非限制性示例中选择此类治疗性蛋白和/或肽制剂,包括:抗体、胞内抗体、单链可变片段(scfv)、亲和体、双特异性和多特异性抗体或结合剂、亲和体、重复蛋白、受体、配体、转运蛋白、溶酶体蛋白、酶、用于酶替代疗法或基因编辑等的酶、肿瘤抑制因子(非限制性示例包括p53、p21、pvhl、apc、cd95、st5、ypel3、st7和/或st15)病毒或细菌抑制剂、细胞组分蛋白、dna和/或rna结合蛋白、dna修复抑制剂、核酸酶、蛋白酶、整合酶、转录因子、生长因子、细胞凋亡抑制剂和诱导剂、毒素(如假单胞菌外毒素)、结构蛋白、神经营养因子(如nt3/4)、脑衍生神经营养因子(bdnf)和神经生长因子(ngf)、离子通道、膜转运蛋白、蛋白稳态因子、与细胞信号传导有关的蛋白、翻译和转录相关蛋白、核苷酸结合蛋白、蛋白结合蛋白、脂质结合蛋白、糖胺聚糖(gag)和gag结合蛋白、代谢蛋白、细胞应激调节蛋白、炎症和免疫系统调节蛋白、线粒体蛋白和热休克蛋白等。
[0032]
在第一方面,本发明涉及ev、ev产生细胞以及ev合成物,其均包含一种na内容物以及一种作为na内容物稳定因子的polya结合蛋白(pabp),所述na内容物包含一段连续腺苷碱基和/或一个与pabp结合的polya尾。术语“polya结合蛋白”或“pabp”应理解为包含可与一段连续腺苷碱基(即一个polya区,通常称为polya尾)结合的任何蛋白。术语“pabp”包括:胞质poly-a结合蛋白(如pabpc1、pabpc3和ipabp)、核poly-a结合蛋白(如pabp1、pabpn1、x-连锁pabp(pabpc5)以及其他可与polya区结合的蛋白(如larp4a、kpaf4、dazl))、冠状病毒n衣壳蛋白、来自布氏锥虫的pabp1、人la蛋白、pan3l以及突变或修饰形式的pabp和polya结合蛋白的片段或结构域,如n端结构域(ntd)、c端结构域(ctd)、pabpδc端或polya结合蛋白的一种或多种rna识别基序(rrm)。可与一段连续腺苷结合(如催化失活的caf1或催化失活的ccr4-核酸外切酶)的其他蛋白也属于本发明适用范围内。此术语应视为涵盖任何来源的pabp(原核或真核)。来自不同物种的pabp的特定示例包括:pabpc1(智人(hs)、小家鼠(mm)、爪蟾(xi))、pabpc2、pabpc3、pabp4(hs、mm、xi)、pabp5(hs和mm)、epab(胚胎pabp、hs、mm、xi)、tpabp(hs和mm)、dm pabp1(dm)、pab-1(ce)和pab-2(ce)、pab-1(cb)和pab-2(cb)、pypabp1和pypabp2(约氏疟原虫)、pab1-pab8(拟南芥)、lipabp(婴儿利什曼虫)、nab2p和pab1(酿酒酵母)、pab2和nab2(粟酒裂殖酵母)、小鼠异质型核蛋白q(hnrnp-q2/syncrip)。术语“polya”可与“聚腺苷酸化”互换使用,并应解释为na内容物分子末端或na内容物分子内的任何一段连续腺苷残基。所述连续腺苷残基的长度可能是10、20、50、70、100、150、200、220、250、270或300个或更多残基或介于两者之间的任何其他数值。本发明可视为涵盖这些序列的衍生物,这些衍生物至少与这些序列具有50%、60%、70%、75%、80%、85%、90%、95%或99%的同源性。在本发明的ev、ev产生细胞以及ev合成物中使用pabp的好处在于,pabp与na内容物的polya尾结合,并稳定产生细胞中的na,从而增加产生细胞中na的稳定性和半衰期,进而通过被动摄取到ev中或借助于rna结合融合蛋白主动摄取到ev中,使na内容物加载水平增加(讨论如下)。此外,当na在ev中时,pabp会稳定并保护na内容物,从而增加产品的保质期,在向受试者施用时,增加半衰期是有效治疗活性的关键。此外,pabp的存在
会稳定na内容物并防止其在输送到受体细胞后降解。因此,靶细胞/受体细胞的半衰期增加会导致当内容物为mrna时从每个输送mrna翻译更多蛋白。由于pabp有助于形成翻译起始复合物,翻译速度也会增加。通过加速形成翻译起始复合物并促进将小核糖体亚基募集到mrna内容物,pabp允许更快地翻译mrna,而不是其他内源性mrna。所形成的翻译起始复合物也允许核糖体在因mrna的环状构象附着于mrna后进行循环,从而更快地产生蛋白(详见下文)。因此,由于其稳定性增加,pabp使mrna在产生细胞和受体细胞中持续更长时间,并更快、更频繁地得到翻译。使用突变形式的pabp的好处在于,蛋白可经工程化改造,以改变对na内容物的结合亲和性,例如,提高结合亲和性,从而延长pabp的结合时间,进而增加内容物mrna的半衰期,或再次修饰pabp与翻译起始复合物的相互作用,以改善亲和性,使复合物的形成速度提高和/或使其形式持续时间延长,从而增加主动翻译mrna的时间,进而增加每个mrna内容物分子所产生的蛋白数量。使用全长或近全长pabp的好处在于,当ntd与mrna内容物3’端的mrna polya尾产生相互作用时,ctd与各种翻译起始因子产生相互作用,如mrna 5’端帽处的eif4g(eif4f复合物的一部分)。这种结合会形成mrna的特征环状结构,此类结构可高效募集核糖体并从3’端到5’端快速循环终止核糖体,在mrna衰变或降解前,使相同na内容物实现高效翻译循环。此类核糖体循环会增加每个mrna所产生的蛋白产物数量,从而改善内容物mrna的生物活性输送和疗效。仅使用pabp的某些片段或结构域的好处在于,这些片段/结构域比全长pabp小,当pabp从ev产生细胞的多核苷酸构建体中过表达时,或当pabp融合到包含一个外泌体多肽和一个na结合蛋白和/或结构域的融合蛋白(用于增强na内容物加载)时,由于其具有较小尺寸,因此比全长pabp更容易加载到ev中。可对pabp进行基因工程化改造,使其仅包含通过与polya尾结合来保持其稳定mrna的能力但会获得较小mrna+pabp(ntd)内容物的ntd,通过被动加载或借助本发明的融合蛋白,此类内容物更容易加载到ev中(讨论如下)。在一个优选实施例中,所述na内容物通过pabp结合稳定,并通过融合蛋白(通常包含至少一个融合到至少一个na结合结构域的外泌体蛋白)结合主动加载到ev中。
[0033]
本发明涉及ev、ev产生细胞以及ev合成物,其均包含一种翻译起始因子以及一种na内容物和一个polya结合蛋白(pabp)。术语“翻译起始因子(tif)”应理解为涉及有助于形成翻译起始复合物或募集、形成或保持翻译起始复合物处的核糖体的任何蛋白因子。优选地,tif是真核tif,如eif4e、eif4g、eif1、eif1a、eif2、eif3、eif5、eif5b和/或eif6。如上所述,翻译起始复合物的存在将创造便利条件,因为这种复合物使mrna形成可促进核糖体循环的环状结构,从而使每个mrna分子产生更多的蛋白产物。这意味着,由于受体细胞中产生更多的治疗性蛋白,每一剂量ev产生的疗效会更高。因此,在一个特定实施例中,本发明涉及不仅包含因存在pabp而稳定的mrna内容物(意味着ev产生细胞、ev和受体细胞中mrna的半衰期增加)的ev,而且ev包含tif(如eif4e)以及稳定mrna内容物意味着稳定mrna内容物在准备被翻译的状态下输送,这意味着以较高的生物活性形式将更多的mrna内容物输送到受体细胞中。
[0034]
术语“外泌体多肽”、“外泌体蛋白”、“外泌体载体蛋白”、“ev蛋白”和“ev多肽”在本文中可互换使用,并且应理解为涉及可用于将多肽构建体(除外泌体多肽之外,其通常还包含na结合结构域,如包含na结合结构域的多肽)运输到适当囊泡结构(即运输到适当ev)的任何多肽。更具体地说,其应视为包含可将融合蛋白构建体运输、转运或穿梭到囊泡结构
(如ev)的任何多肽。此外,这些术语应理解为包含自然存在和/或在任何细胞来源的ev(优选外泌体)中富集的任何多肽。此类外泌体多肽的示例包括cd9、cd53、cd63、cd81、cd54、cd50、flot1、flot2、cd49d、cd71(也称为转铁蛋白受体)及其内体分选结构域,即转铁蛋白受体外泌体分选结构域、cd133、cd138(多配体蛋白聚糖1)、cd235a、alix、aardc1、同线蛋白1、同线蛋白2、lamp2a、lamp2b、多配体蛋白聚糖2、多配体蛋白聚糖3、多配体蛋白聚糖4、tspan8、tspan14、cd37、cd82、cd151、cd231、cd102、notch1、notch2、notch3、notch4、dll1、dll4、jag1、jag2、cd49d/itga4、itgb5、itgb6、itgb7、cd11a、cd11b、cd11c、cd18/itgb2、cd41、cd49b、cd49c、cd49e、cd51、cd61、cd104、cd2、cd3ε、cd3ζ、cd13、cd18、cd19、cd30、tsg101、cd34、cd36、cd40、cd40l、cd44、cd45、cd45ra、cd47、cd86、cd110、cd111、cd115、cd117、cd125、cd135、cd184、cd200、cd279、cd273、cd274、cd362、col6a1、agrn、egfr、gapdh、glur2、glur3、hla-dm、hspg2、l1cam、lamb1、lamc1、lfa-1、lgals3bp、mac-1α、mac-1β、mfge8、ptgfrn、slit2、stx3、tcra、tcrb、tcrd、tcrg、vti1a、vti1b、纤连蛋白、rab7、14-3-3ζ/δ、14-3-3ε、hsc70、hsp90、hspa13以及其他外泌体多肽及其任何组合或衍生物,但是,可将多肽构建体运输到ev中的很多其他多肽均在本发明的范围内。在一些实施例中,所述外泌体蛋白为跨膜蛋白。在本发明的一些实施例中,至少一个外泌体多肽融合到na结合结构域,以形成存在于ev中的融合蛋白,从而协助na内容物分子加载。此类融合蛋白还可包含各种其他组分,以优化其功能,包括连接肽、跨膜结构域、胞质结构域、多聚化结构域、从外泌体多肽中释放na结合结构域的结构域等。
[0035]
术语“na结合结构域”或“na结合多肽”或“na结合蛋白”在本文中可互换使用,并涉及可结合一段核苷酸、核苷和/或核酸碱基的任何蛋白或任何蛋白结构域。na结合结构域可结合rna、dna、rna和dna混合体、特定类型的na,如shrna、mirna、mrna、grna、pri-mirna、pre-mirna、环状rna、pirna、trna、rrna、snrna、incrna、核酶、微环dna、质粒dna等。此外,na结合结构域还可结合化学修饰核苷酸,如2'-o-me、2'-o-allyl、2'-o-moe、2'-f、2'-ce、2'-ea 2'-fana、lna、clna、ena、pna、硫代磷酸酯、三环dna等。此外,na结合结构域还可结合na的特定序列、结构域(如重复序列)或na基序(如茎环或发夹)。na结合结构域的此类结合位点可天然存在于目标na内容物分子中和/或可经工程化改造到na内容物分子中,以进一步增强ev加载和生物活性输送。na结合结构域对核酸的结合亲和性使核酸以足够高的亲和性结合,以穿梭到外泌体中,但是,结合亲和性的水平并未高到可阻止核酸随后释放到靶细胞内,这使核酸在输送到靶细胞后便具有生物活性。
[0036]
在一些实施例中,本发明涉及na结合蛋白,尤其是rna结合蛋白和dna结合蛋白及其na结合结构域。na结合蛋白的非限制性示例包括hnrnpal、hnrnpa2b1、ddx4、adad1、dazl、elavl4、igf2bp3、samd4a、tdp43、fus、fmr1、fxr1、fxr2、eif4a13、ms2外壳蛋白及其任何结构域、部分或衍生物,更广泛地说,rna结合蛋白和结构域的特定子类,如mrna结合蛋白(mrbp)、pre-rrna结合蛋白、trna结合蛋白、小核或核仁rna结合蛋白、非编码rna结合蛋白、mirna结合蛋白、shrna结合蛋白和转录因子(tf)。此外,各种结构域和衍生物也可用作na结合结构域,将na内容物运输到ev中。rna结合结构域的非限制性示例包括小rna结合结构域(rbd)(可以是单链和双链rbd(ssrbd和dsrbd),如dead、kh、gtp_eftu、dsrm、g-patch、ibn_n、sap、tudor、rnasea、mmr-hsr1、kow、rnaset、mif4g、zf-ranbp、ntf2、paz、rbm1ctr、pam2、xpo1、piwi、csd和ribosomal_l7ae)。只要维持其关键功能(即运输目标na内容物(如mrna或
短rna)的能力),此类rna结合结构域就可以多个的形式、单独或与其他结构域组合存在,并且还可形成较大rna结合蛋白构建体的一部分。
[0037]
在优选实施例中,本发明涉及两组na结合结构域,即puf蛋白和crispr相关多肽(cas),特别是cas6和cas13,以及各种类型的na结合适配子。本发明使用术语puf蛋白来涵盖所有相关蛋白及此类蛋白(也可称为pum蛋白)的结构域(例如,人pumilio同系物1(pum1)、pumx2或pufx2(pum1的重复序列)等)或可从任何puf(pum)蛋白获得的任何na结合结构域。puf蛋白的典型特征在于存在8个连续的puf重复序列,每个重复序列约包含40个氨基酸,通常侧接有两个相关序列csp1和csp2。每个重复序列均具有包含芳香族残基和碱性残基的“核心共有序列”。rna结合需要整个puf重复序列簇。显著地,同一区域还与蛋白共调节因子产生相互作用,并在很大程度上充分弥补了puf蛋白突变体的缺陷,这使puf蛋白非常适用于本发明中使用的突变。此外,puf蛋白是可释放na结合结构域的高度优选示例,其以合适的亲和性与na内容物分子结合,从而使puf蛋白可释放地、可逆地附着于na内容物。puf蛋白存在于大多数真核生物中,并参与胚胎发生和发育。puf具有一个结合rna的结构域,此结构域由8个通常包含36个氨基酸的重复序列组成,其为本专利申请中通常用于rna结合的结构域。每个重复序列均结合一个特定的核苷酸,通常是位置12和16处的氨基酸通过与氨基酸13的堆积相互作用赋予特异性。天然存在的puf可以结合核苷酸腺苷、尿嘧啶和鸟苷,工程化改造puf还可以结合核苷酸胞嘧啶。因此,此系统是模块化的,并且可以通过转换重复结构域的结合特异性来改变puf结构域所结合的8个核苷酸序列。因此,本发明所述的puf蛋白可以是天然或经工程改造结合rna分子中的任何位置,或另一种处理方式可选择针对不同序列具有不同结合亲和性的puf蛋白并对rna分子进行工程化改造,以包含所述序列。此外,存在以序列特异性方式结合16-核苷酸的工程化改造和/或重复puf结构域,这还可用于进一步增加na内容物分子的特异性。因此,可对puf结构域进行修饰,以结合具有不同亲和性和序列长度的任何序列,这使此系统高度模块化并且适用于本发明所涉及任何rna内容物分子。可用作本发明所述na结合结构域的puf蛋白及其区域和衍生物包括puf蛋白的以下非限制性列表:来自秀丽隐杆线虫的fbf、fbf/puf-8/puf-6,-7,-10;来自黑腹果蝇的pumilio;来自酿酒酵母的puf5p/mpt5p/uth4p、puf4p/ygi014wp/ygi023p、puf5p/mpt5p/uth4p、puf5p/mpt5p/uth4p、puf3p;来自盘基网柄菌的pufa;人pum1(pumilio 1,有时也称为puf-8r)及其任何结构域、包含来自至少两个pum1的na结合结构域的多肽;任何截短、修饰或工程化改造puf蛋白,如puf-6r、puf-9r、puf-10r、puf-12r和puf-16r或其衍生物;以及来自爪蟾的x-puf1。特别合适的本发明所述na结合puf包括以下几项:puf531、puf mrna loc(有时称为工程化改造puf或pufeng)和/或pufx2(pct/ep2018/080681中提供了其序列)及其任何衍生物、结构域和/或区域。puf/pum蛋白高度有利,因为它们可以选自人类来源。
[0038]
在使用puf蛋白和crispr相关多肽(cas)(特别是cas6和cas13)和/或各种类型的na结合适配子的实施例中,本发明提供了一种现有技术无法实现的可释放加载系统。因此,重要的是,与现有技术完全相反,本发明涉及借助于可释放na结合结构域加载na内容物分子的ev,其中,所述na结合结构域形成融合多肽(包含外泌体多肽)的一部分。本发明的na结合结构域使na结合结构域和na内容物分子之间具有可编程、可修饰的亲和性,从而产生包含融合多肽(包含na结合结构域和至少一个na内容物分子)的ev,其中,所述融合多肽构建
体的na结合结构域以可编程的、可逆的、可修饰的方式与na内容物分子产生相互作用,从而可加载到ev中,并释放ev中和/或靶细胞中以及与靶细胞相关的na内容物分子。
[0039]
因此,在有利实施例中,本发明涉及与外泌体蛋白发生融合的真核na结合蛋白。在一个优选实施例中,na结合结构域来自puf蛋白家族,如puf531、工程化改造puf和/或pufx2。重要的是,puf蛋白优选用于mrna的ev介导输送,由于puf蛋白的序列特异性,可高度控制和特异性加载mrna药物内容物。在优选实施例中,puf蛋白与跨膜蛋白或可溶性外泌体蛋白有利结合。有利融合蛋白构建体包括以下非限制性示例:cd63-puf531、cd63-pufx2、工程化改造cd63-puf、cd81-puf531、cd81-pufx2、工程化改造cd81-puf、cd9-puf531、cd9-pux2、工程化改造cd9-puf以及其他基于跨膜蛋白的融合蛋白,优选基于融合到一种、两种或更多puf蛋白的四次跨膜外泌体蛋白。包含puf蛋白和至少一种可溶性外泌体蛋白的有利融合蛋白包括以下非限制性示例:同线蛋白-puf531、同线蛋白-pux2、工程化改造同线蛋白-puf、多配体蛋白聚糖-puf531、多配体蛋白聚糖-pux2、工程化改造多配体蛋白聚糖-puf、alix-puf531、alix-pux2、工程化改造alix-puf以及融合到一种puf蛋白的任何其他可溶性外泌体蛋白。
[0040]
puf蛋白对靶na内容物分子具有可修饰的序列特异性,这一事实使它们成为融合到外泌体多肽配偶体的理想na结合结构域。因此,在本发明的优选实施例中,使用可释放na结合结构域(作为包含外泌体蛋白的融合蛋白的一部分)将na内容物分子加载到ev中,其中,所述na结合结构域和na内容物分子之间的相互作用有利地基于对靶核苷酸序列的特异性,而不是基于靶核苷酸二级结构(因为二级结构不能实现序列特异性)。在优选实施例中,na内容物分子经工程化改造,包含和/或天然包含选作na结合结构域的puf蛋白的靶核苷酸序列。如上所述,此类靶核苷酸序列可以是mrna的3'utr的一部分,或者可引入到任何na内容物分子中,如mrna、shrna、mirna、incrna、dna等,从而允许puf蛋白与na内容物分子结合。na内容物分子上的puf结合位点通常要长于由许多其他rna结合蛋白(如ms2)结合的序列,其仅结合识别4个核苷酸和茎环,因此,靶结合位点上的优选核苷酸段可以是5个核苷酸(nt)、6nt、7nt、8nt、9nt、10nt、11nt、12nt、13nt、14nt、15nt、16nt、17nt、18nt、19nt、甚至20nt或更长,具体取决于对于na结合结构域可修饰序列特异性的需求。在一个优选实施例中,puf蛋白对长度为6nt、8nt、9nt、10nt、12nt或16nt的天然存在和/或人工形成的na内容物分子结合位点具有特异性。
[0041]
crispr相关多肽(cas)代表另一组na结合结构域,特别是可包括cas6和cas13以及任何其他rna结合cas分子。cas6以高亲和性结合前体crispr rna(crrna),并对其进行处理,以便稍后整合到cas9中。rna分子的切割速率可调节并高度定义,因此,也可采用非常准确的方式定义rna分子与cas6之间的结合时间,这对于本发明的目的很重要。可使用已经突变以提高或降低rna切割效率的cas6或cas13的突变版本。可使用已经突变以提高或降低rna结合亲和性的cas6或cas13的突变版本。例如,在受体细胞中释放rna内容物分子时,这将是一个优势。然后,可以调节所定义的结合时间,以在囊泡内释放rna分子,而不是在产生细胞内释放。cas6可识别的rna序列可经工程化改造,以插入目标na分子中。cas13可经工程化改造,以仅结合其定义的rna靶点,但不会使其降解。通过改变sgrna分子的序列,可以调节cas13-sgrna复合物,以结合20-30个核苷酸之间的任何rna序列。例如,使用来自cas蛋白的na结合结构域对于短rna(如shrna或mirna)的输送特别有利。在这种情况下,所选cas多
肽的切割活性可用于释放来自与cas6结合的结合位点的shrna内容物分子。此外,与puf蛋白的情况相同,cas蛋白也是可释放na结合结构域的高度优选示例,其以合适的亲和性与na内容物分子结合,从而使cas蛋白可释放地、可逆地附着于na内容物。与基于puf的na结合结构域相同,cas蛋白代表可释放、不可逆的na结合结构域,对靶na内容物分子具有可编程、可修饰的序列特异性,可以较低的总亲和性实现更高的特异性,从而将na内容物加载到ev中,并在靶点位置释放na内容物。
[0042]
因此,将puf结合或cas介导加载到na内容物分子(如mrna、shrna和mirna)的ev中,以及pabp介导稳定na内容物分子(通过pabp与na内容物分子的一段腺苷残基之间的相互作用)代表本发明的一个高度有利的实施例,可实现高效na内容物输送和生物活性。如上所述,在本发明的所有实施例中,pabp可从相同或不同的多核苷酸构建体单独翻译,或可包含在融合多肽中,以进行ev加载。用于加载na内容物分子的多肽构建体的示意图如下(下面的注释不应解释为说明c端和/或n端方向或组分自身的任何特定序列,而是仅旨在说明融合多肽的适当组分);
[0043]
外泌体多肽-na结合结构域-pabp
[0044]
在某些实施例中,所述融合多肽进一步包含一种转录起始因子(如eif)(如下图所示):
[0045]
外泌体多肽-na结合结构域-pabp-eif
[0046]
此外,如本文所述,多肽构建体(如上图所示)还可包含连接肽、多聚化结构域、蛋白酶切割或自发性释放的切割位点等,具体取决于融合多肽的所需功能。
[0047]
本发明所述的另一组na结合结构域为na适配子结合结构域。此类na适配子结合结构域是na适配子可特异性结合的结构域、区域、氨基酸段或整个多肽或蛋白。适配子是形成二级和/或三级结构以识别分子的rna序列,类似于抗体对其靶抗原的亲和性。因此,这些rna分子可以高亲和性识别特定氨基酸序列。在本发明中,通过将特定核苷酸序列插入na分子中以识别特定氨基酸序列来应用rna适配子。此类氨基酸序列可经工程化改造到外泌体载体多肽中和/或附近,使适配子(经工程改造到na内容物分子中和/或附近)可与其结合,从而借助于外泌体多肽将na内容物分子穿梭到ev中。具有适当特征的两个适配子为对一段组氨酸(his)氨基酸具有高亲和性的his适配子和靶向hiv tat结构域的适配子。适配子序列优选插入mrna的3'和/或5’未翻译区。还可以将两个或多个适配子结合到mrna内容物分子中,以增加对外泌体载体蛋白的特异性和亲合力。重要的是,本发明的所有na结合结构域均提供可编程的、序列特异的、可逆的、可释放的na内容物分子结合,这与在现有技术中发现的高亲和性、不可逆的rna结合完全相反。在本发明的优选实施例中,na结合结构域是puf蛋白或cas蛋白,因为它们具有可易于编程的性质和序列特异性,并且可与na内容物分子实现可逆的、可释放的结合。重要的是,作为na结合结构域的cas蛋白和puf蛋白的序列特异性优选基于与靶na分子上的至少6nt(优选至少8nt)的相互作用,当通过低亲和性相互作用结合时,可实现na内容物分子的高效ev介导输送。na内容物分子上的至少6nt结合位点优选以连续核苷酸序列的形式存在。因此,na内容物分子的结合位点长度优选对应于两个密码子。适配子介导加载与pabp介导稳定增强有利结合,尤其是在na结合适配子特别短时,可使融合多肽构建体(可包含pabp自身)的尺寸相对密集。
[0048]
因此,在另一个重要方面,本发明涉及细胞外囊泡(ev),所述细胞外囊泡包含pabp
以及与至少一个融合多肽结合的na内容物分子,所述融合多肽包含至少一个核酸(na)结合结构域和至少一个外泌体多肽。由于na结合结构域的存在,ev通常进一步包含拷贝数更高的na内容物分子。使用此策略,每个ev中包含的完整、稳定na内容物分子的数量均相当可观,这是对现有技术的明显改进,当前技术通常加载效率极低并存在mrna稳定性相关问题。在本发明中,融合多肽构建体的创新性设计是指将至少一个na内容物分子非常高效地运输到ev中(借助于融合多肽),随后是显著改进的释放过程,这两个过程均通过因pabp的存在所介导的稳定性增加而增强。na结合结构域(包含在融合多肽中)和na内容物分子之间结合的可释放属性是本发明的一个重要方面,因为这将允许在ev产生细胞中结合na内容物分子(其中,na内容物分子通常过表达),同时可在靶细胞内和/或附近输送生物活性na分子。
[0049]
如上所述,在使用puf蛋白和crispr相关多肽(cas)(特别是cas6和cas13)和/或各种类型的na结合适配子的实施例中,本发明还具有有利作用,即,在na结合结构域和na内容物分子之间实现可编程、可修饰的低亲和性相互作用,使本发明可将ev高效加载到ev产生细胞中,同时还可在适当位置释放na分子(通常在靶细胞内),其中,所述na内容物分子和na结合结构域之间相互作用的低亲和性和可释放性质高度有利。此外,与现有技术公开ms2作为与4nt和茎环结合的高亲和性rna结合蛋白不同,本发明允许以序列特异性低亲和性或中亲和性与更长的核苷酸段结合,更具体地,长度为6nt或8nt。
[0050]
更长的结合位点长度使得能够引入一系列不同的突变,这些突变产生具有一系列修饰结合亲和性的结合位点,从而产生上述可编程的低亲和性相互作用。例如,将单点突变引入6或8核苷酸区中,会微妙地修饰结合亲和性,然而,即使是ms2较短4核苷酸结合区中的单个突变,也会显著影响ms2对rna的结合亲和性。更长的核酸长度提供引入一种或多种突变的更大范围,这些突变会影响蛋白对核酸的结合亲和性。同样,需要更长的待结合核苷酸段,会导致产生更多的氨基酸,这些氨基酸可与更长的核苷酸序列产生相互作用,从而提供更多的可能性,使存在相互作用的氨基酸发生突变,并再次产生具有各种结合亲和性的更大范围的可能蛋白突变体。puf、cas6和cas13均具有更长的核苷酸结合位点和更大的蛋白结合位点,其优势在于:与通过ms2蛋白或ms2 rna序列突变相比,通过puf、cas6和cas13突变可实现更大范围的亲和性。因此,如果需要改善核酸内容物的释放,则这种更长的序列可实现对于核酸和/或结合蛋白以特异性调节对单个目标内容物的结合亲和性方面的进一步工程化改造。如上所述,控制与核苷酸内容物结合的亲和性从而修饰和控制核苷酸内容物的可释放性特征是本发明相对于现有技术的一个显著优势,这可实现生物活性核酸的输送和释放。当然,在需要高亲和性结合的情况下,可有利使用ms2。
[0051]
在一个实施例中,可从包括以下几项的一组中选择所述na内容物分子:shrna、mirna、mrna、grna、pri-mirna、环状rna、pirna、trna、rrna、narna、incrna、核酶、微环dna、质粒dna、环二核苷酸,但是,任何类型的na分子基本上均可包含在本发明所述的ev中。单链和双链na分子均在本发明的范围内,并且na分子可以是天然存在的分子或化学合成分子,其可包含化学修饰核苷酸,如2'-o-me、2'-o-allyl、2'-o-moe、2'-f、2'-ce、2'-ea、2'-fana、lna、clna、ena、pna、硫代磷酸酯、三环dna等。重要的是,尽管本发明非常适用于通过内源方式加载na内容物分子(如mrna、环状rna、shrna等),但也适用于加载外源性na分子,可通过将ev产生细胞暴露于所讨论的na分子和/或通过与ev自身共同孵育、电穿孔或配制来加载这些外源性na分子。
[0052]
在一个特定实施例中,本发明的ev包含稳定na内容物的pabp,所述na内容物借助于融合蛋白(包含一个融合到一个na结合结构域的外泌体蛋白)主动加载到ev中,优选地,所述融合蛋白包含融合到核酸结合蛋白pufeng的外泌体蛋白cd63或其一部分。在一个优选实施例中,本发明所述的多核苷酸构建体包含一个编码融合蛋白(包含一个外泌体蛋白(如cd63或同线蛋白或任何其他适当的ev蛋白)和一个na结合蛋白(如pufeng))和pabp或其片段或结构域的编码区,所述pabp或其片段或结构域在不同启动子的控制下融入同一多核苷酸构建体中或由p2a切割位点分离,导致在翻译水平上分离两种蛋白产物。本实施例的优势在于,仅需转染工程化改造细胞蛋白组分的单一构建体,即可简化产生ev的稳定细胞的生成过程(在一些实施例中,na内容物也可融入同一多核苷酸构建体中,但也可存在于第二构建体中,从而产生双稳定工程化改造ev产生细胞)。
[0053]
在另一个实施例中,本发明包含ev,所述ev包含一个融合蛋白,所述融合蛋白包含一个外泌体蛋白、一个na结合结构域以及pabp或其片段或结构域。本实施例也具有相同的好处,即,仅需使用单一蛋白编码构建体转染产生蛋白构建体等的细胞,即可简化所述ev稳定细胞的生成过程。此外,这种安排还具有以下好处:由于融合蛋白的外泌体蛋白组分,过表达的pabp主动加载到ev(因为它融入融合蛋白中)中,重要的是,pabp靠近被na结合蛋白拉入ev中的na内容物。
[0054]
在另一个实施例中,pabp蛋白可融合到na结合蛋白,然后,相应na结合位点将经工程化改造到na内容物分子中,使pabp过表达特异性靶向na内容物,而不是可能天然存在于产生细胞中的任何其他na(例如,存在于胞质溶胶中的mrna)。因此,这种方法可增加靶内容物na的稳定性。
[0055]
在一个特定实施例中,na结合结构域是cas6或cas13,na内容物分子是shrna或mirna。cas6/cas13与shrna内容物的结合很有利,因为cas6/cas13的先天活性将导致从与cas6或cas13结合的na结合结构域中切割shrna,从而从融合蛋白和na结合结构域之间的复合物中释放shrna。此外,为了增强shrna的稳定性,一段腺苷残基可经工程化改造到shrna上,以在ev产生细胞及ev自身中实现结合并由pabp稳定。输送到靶标环境中后,可以推测,cas6或cas13将切割shrna-na结合位点-polya段多核苷酸的治疗活性shrna部分,从而释放shrna,使其执行其基因沉默功能。
[0056]
在本发明的优选实施例中,本发明所述的na内容物分子包含(i)融合多肽的na结合结构域的至少一个结合位点以及(ii)治疗性多核苷酸结构域,即,负责发挥生物作用的na内容物分子部分,例如,mrna的编码序列或shrna或mirna的沉默序列。在优选实施例中,na内容物分子包含至少两个结合位点,甚至更优选更高数量的结合位点,如3、4、5、6、7、8、9、10、15或甚至更大的数量。发明人已经认识到,包含4-8个结合位点可将na内容物分子最优地加载到ev中,且不会对内容物的释放和生物活性输送产生不利影响。na结合结构域的结合位点可通过基因工程化改造转移至3'区和/或5'区中和/或旁侧,和/或通过序列优化将其置于na内容物分子的编码区中。
[0057]
本发明所述的na内容物分子可有利地包含至少一个位于至少一个结合位点和治疗性和/或预防性多核苷酸结构域之间的切割位点,以便释放na内容物分子中负责其生物预防和/或治疗活性的部分。
[0058]
na内容物分子通常旨在执行一系列功能,例如,编码目标蛋白(如具有治疗活性的
蛋白)、通过与靶点的反义相互作用使靶核苷酸序列沉默、转换和/或阻断剪接、介导靶核苷酸序列切割,例如,通过rnase h介导的切割或risc复合物介导的rna干扰(rnai)。在特别相关的实施例中,na内容物分子可执行一种以上的功能,例如,它可以编码目标蛋白,并包含可具有引导功能的na序列。这方面特别有利的一个示例是编码crispr相关蛋白(如cas、cas9(在登录号为q99zw2的非限制性示例cas9中)和/或cas6)并包含用于将crispr相关蛋白引导到靶序列以进行基因编辑的引导链和/或用于同源性定向修复的校正dna链的na分子。在此类实施例中,特别有利的是:在na分子中包含切割位点,以便释放由na内容物分子编码的蛋白和/或na内容物分子中包含的引导链。
[0059]
可由na(在本实施例中,有利地是mrna)内容物分子编码的目标蛋白(poi)的非限制性示例包括以下几项:抗体、胞内抗体、单链可变片段(scfv)、亲和体、双特异性和多特异性抗体或结合剂、受体、配体、用于酶替代疗法或基因编辑等的酶、肿瘤抑制因子、病毒或细菌抑制剂、细胞组分蛋白、dna和/或rna结合蛋白、dna修复抑制剂、核酸酶、蛋白酶、整合酶、转录因子、生长因子、细胞凋亡抑制剂和诱导剂、毒素(如假单胞菌外毒素)、结构蛋白、神经营养因子(如nt3/4)、脑衍生神经营养因子(bdnf)和神经生长因子(ngf)及其单独亚基(如2.5sβ亚基)、离子通道、膜转运蛋白、蛋白稳态因子、与细胞信号传导有关的蛋白、翻译和转录相关蛋白、核苷酸结合蛋白、蛋白结合蛋白、脂质结合蛋白、糖胺聚糖(gag)和gag结合蛋白、代谢蛋白、细胞应激调节蛋白、炎症和免疫系统调节蛋白、线粒体蛋白和热休克蛋白等。在一个优选实施例中,所述编码蛋白是具有完整核酸酶活性的crispr相关(cas)多肽,其与rna链相关(即携带它),所述rna链使cas多肽可在通过ev输送后在靶细胞中发挥其核酸酶活性。或者,在另一个优选实施例中,cas多肽可催化失活,以实现靶向基因工程化改造。另一个替代选择可以是任何其他类型的crispr效应子,如单rna引导核酸内切酶cpf1。包含cpf1是本发明的一个特别优选实施例,由于它会通过交错双链断裂切割靶dna,可从氨基酸球菌属或毛螺菌科等物种中获得cpf1。在另一个示例性实施例中,cas多肽也可融合到转录激活因子(如p3330核心蛋白)中,以特异性诱导基因表达。其他优选实施例包括源自以下几项的一组中的蛋白:用于溶酶体贮积症的酶,例如葡糖脑苷脂酶,如伊米苷酶、α-半乳糖苷酶、α-l-艾杜糖醛酸酶、艾杜糖醛酸-2-硫酸酯酶和艾杜硫酸酯酶、芳基硫酸酯酶、加硫酶、酸性-α-葡萄糖苷酶、鞘磷脂酶、半乳糖脑苷脂酶、半乳糖神经酰胺酶、神经酰胺酶、α-n-乙酰半乳糖胺酶、β-半乳糖苷酶、溶酶体酸性脂肪酶、酸性鞘磷脂酶、npc1、npc2、乙酰肝素硫酸脂酶、n-乙酰葡糖胺糖苷酶、乙酰肝素-α-氨基葡萄糖苷-n-乙酰转移酶、n-乙酰氨基葡萄糖6-硫酸酯酶、半乳糖-6-硫酸酯硫酸酯酶、半乳糖-6-硫酸酯硫酸酯酶、透明质酸酶、α-n-乙酰神经氨酸酶、glcnac磷酸转移酶、粘脂蛋白1、棕榈酰蛋白硫酯酶、三肽基肽酶i、棕榈酰蛋白硫酯酶1、三肽基肽酶1、battenin、linclin、α-d-甘露糖苷酶、β-甘露糖苷酶、天冬氨酰氨基葡糖苷酶、α-l-岩藻糖苷酶、胱氨酸转运蛋白、组织蛋白酶k、唾液酸转运蛋白、lamp2和氨基己糖苷酶。在其他优选实施例中,poi可以是修饰炎症反应的细胞内蛋白,如甲基化酶和溴区结构域等表观遗传类蛋白;或修饰肌肉功能的细胞内蛋白,如myod或myf5等转录因子;调节肌肉收缩性的蛋白,如肌球蛋白、肌动蛋白、钙结合蛋白,如肌钙蛋白;或结构蛋白,如抗肌萎缩蛋白、肌营养相关蛋白、肌联蛋白、伴肌动蛋白、抗肌萎缩蛋白相关蛋白,如小肌营养蛋白、互养蛋白、中间丝蛋白、肌间线蛋白、肌聚糖蛋白、肌营养不良蛋白聚糖、肌长蛋白、集聚蛋白和/或fukutin。除非其名称、任何其他命名法另有说明,或本领域的技术人员
熟知,否则poi通常为人类来源的蛋白或肽,并且可在uniprot、rcsb等各种公开可用的数据库中找到。
[0060]
提供na内容物稳定性以及改善将na内容物加载、释放、生物活性输送和高效翻译到靶细胞和/或特定器官、组织和身体区室的关键在于na内容物分子设计、编码pabp蛋白或其片段的构建体设计以及融合多肽构建体的设计和编码翻译起始因子的构建体设计。发明人已发现,特别有效的实施例为包含融合多肽的ev,所述融合多肽包含至少一个在一侧或两侧上侧接有至少一个na结合结构域(即,在一侧或每侧上的至少一个na结合结构域)的外泌体多肽。或者,在各种情况下,na结合结构域均可插入外泌体多肽的至少一个位置(例如,在cd63的囊泡外环上),例如,当需要在ev外部显示na结合结构域来增强外源性加载时。可立即在c端和/或n端侧接外泌体多肽,但最有利的设计是在外泌体多肽和na结合结构域之间包含连接肽,以提供间隔和灵活性,从而维持外泌体多肽和na结合结构域的活性。此类连接肽可以有利地包括含有特定数量重复序列的甘氨酸-丝氨酸(gs)连接肽。发明人已经认识到,1-4个重复序列是最有利的,其提供足够的灵活性且不会使融合多肽过于非结构化,但是,更长的连接肽和非gs连接肽也属于本发明适用范围。此外,如上所述,在有利实施例中,pabp可融合到包含na结合结构域和外泌体多肽的融合多肽。如上所述,连接肽、释放结构域和切割位点可有利地用于这种融合蛋白构建体,以使不同的功能结构域可以执行其相应活动(即,ev蛋白将融合蛋白转运到ev中;na结合结构域与目标na内容物分子结合;以及pabp与一段腺苷残基结合,以稳定na内容物并增强其生物活性)。如上所述,对于涉及外源性加载na内容物分子的应用,ev优选包含融合多肽,所述融合多肽包含至少一个融合到其n端和/或其c端和/或外泌体多肽任何囊泡外(即存在于ev外部)区域的至少一个na结合结构域的外泌体多肽,使na结合结构域暴露在外泌体表面上。
[0061]
融合多肽构建体外泌体多肽组分的设计和选择是高效形成ev、将na加载到ev中以及释放na内容物分子的关键。
[0062]
如上所述,本发明所述的ev借助于融合多肽加载na内容物分子。在不希望受到任何理论约束的情况下,可以推测,加载与ev产生细胞内ev的形成有关,或是外源性地通过将na内容物分子与工程化改造ev一起孵育而发生。融合多肽通常可结合na内容物分子,同时在ev产生细胞中共表达,并将其运输到囊泡中,然后作为ev释放。如前所述,na内容物分子可在与融合多肽相同的ev产生细胞中表达,和/或可在ev形成并可选地纯化后,将其外源性地加载到ev中。na内容物在ev产生细胞中的共表达是高度有利的实施例,因为在单个细胞中以单个步骤产生ev,这可以缩放过程,并简化上游和下游处理。na内容物分子(如mrna、shrna、mirna、环状rna、dna、反义寡核苷酸等)可从与融合多肽构建体相同的多核苷酸构建体中表达,所述构建体还可包含pabp,或每个na内容物分子、融合多肽构建体和pabp均可从单独的构建体中或以任何组合形式表达。每种方法方法各具优势:使用一种构建体可确保融合多肽和na内容物分子(可选地,融合蛋白和翻译起始因子(tif))一起翻译/转录,而使用多于一个构建体则使这些组分差异表达,例如,pabp构建体、tif构建体、融合多肽和/或na内容物分子的较高表达水平。在优选实施例中,将从中表达pabp和na内容物分子(在某些实施例中,可选融合多肽和/或tif)的多核苷酸构建体有利稳定地引入ev产生细胞中,确保一致地、可再生地产生加载na的ev并实现较高产量。在优选实施例中,使用包含pabp和na内容物分子(在某些实施例中,可选融合多肽和/或tif)的双顺反子或多顺反子载体(也称为
多核苷酸构建体或多核苷酸等)稳定地转染和/或转导ev产生细胞。此类双顺反子或多顺反子构建体可包含ires元素或2a肽键,允许表达:(i)pabp;(ii)目标na内容物;(iii)包含na结合结构域和外泌体蛋白的融合多肽;以及(iv)tif。除使用双顺反子或多顺反子载体之外,多个或双向启动子代表另一种稳定插入单一构建体的易处理方法,所述构建体编码将加载到本发明所述ev中的两个目标组分。显然,在替代实施例中,尽管使用单一构建体可能有利,因为它可以使pabp和na内容物分子(可选融合多肽和/或tif)自身保持等摩尔浓度,也可以简化稳定克隆细胞系的形成,但是,也可以将两个或多个多核苷酸构建体(如质粒)转染和/或转导到ev产生细胞中。重要的是,通常将本发明的ev产生细胞设计为过表达至少一个多核苷酸构建体,这允许在ev产生细胞中以合适的浓度适当地产生na内容物分子,从而允许na结合结构域可逆地、可释放地附着于na分子。多核苷酸过表达是一种重要的工具,其允许ev产生细胞中na内容物分子具有较高的浓度,同时允许在na内容物分子浓度较低的靶细胞中释放na内容物分子。
[0063]
在进一步的实施例中,本发明所述的ev可包含至少一个靶向部分,以靶向输送到目标细胞、组织、器官、细胞器和/或区室。可靶向的器官、组织和细胞类型包括:脑、神经元细胞、血脑屏障、肌肉组织、眼睛、肺脏、肝脏、肾脏、心脏、胃、肠、胰腺、红细胞、白细胞(包括b细胞和t细胞)、淋巴结、骨髓、脾脏和癌细胞。靶向部分可包含在融合多肽自身中,当使用具有跨膜结构域的外泌体多肽使靶向部分在ev的表面上显示时,这特别有利。靶向部分可以是蛋白、肽、单链片段或抗体的任何其他衍生物等。靶向部分还可以形成包含在ev中的单独多肽构建体的一部分。此外,本发明的ev中包含的融合多肽还可包含各种其他部分,以增强生物活性输送。此类部分和/或结构域可包括功能结构域的以下非限制性示例:(i)多聚化结构域,其使融合多肽二聚化、三聚化或多聚化,以改善ev形成和/或加载;(ii)连接肽(如上所述),以避免空间位阻并提供灵活性;(iii)释放结构域,如具有自我切割活性的顺式切割元素(如内含肽),其可用于释放融合多肽和/或na内容物的特定部分;(iv)rna切割结构域,其用于改善na在受体细胞中的释放,例如,编码核酸酶的结构域,如cas6和cas13;(v)内体逃逸结构域,如ha2、vsvg、gala、b18等;和/或(vi)核定位信号(nls)。
[0064]
本发明还涉及na内容物分子的各种创新性修饰,这些修饰是确保高效率加载、释放和生物活性输送的关键。例如,通过将na内容物分子设计为线性或环状,可以增加或减少加载效率和稳定性等方面。此外,通过优化序列设计,还可能影响na内容物的二级和三级结构,这可通过促进na结合结构域对靶na的易接近性来进一步促进加载。
[0065]
在另一个有利实施例中,na内容物分子可包含其他部分,以增强加载、改善释放、增加组织比活性和/或增加na内容物分子的稳定性,从而增加效力。例如,na内容物分子可包含以下一项或多项:(i)mirna结合位点,其中,此类位点可具有组织和/或细胞类型特异性,以驱动优先的细胞和/或组织比活性;(ii)一个以上的polya尾(如2个、3个或甚至4个polya尾);(iii)位于5’区和/或3'区中的至少一个茎环结构,以抑制核酸酶降解;(iv)rna聚合酶,以在需要它的实施例中驱动na内容物分子的转录,例如,如果na是dna;(v)密码子优化序列,以增加na稳定性,尤其是mrna稳定性;(vi)位于5'端和/或3'端中的至少一个杂化utr,以提高mrna的翻译效率;和/或(vii)核酶。只要pabp仍可结合一段连续腺苷残基,从而防止或减少na内容物降解,polya“尾”或一段连续腺苷残基即可位于na内容物分子末端或na内容物分子的其他元素内。
[0066]
重要的是,现有技术在mrna输送到受体细胞后便不会尝试改善其翻译。存在本发明的pabp和tif(可选)时,会募集翻译起始复合物和核糖体,以快速、重复地翻译已稳定的mrna内容物,从而增加从每个内容物mrna翻译的蛋白数量,进而增加加载ev的疗效。
[0067]
如上所述,ev通常不以单个囊泡的形式存在,而是以大量多个囊泡的形式存在,因此,本发明还涉及ev群体。在有利实施例中,在整个此类群体中,每个ev的平均na内容物分子数量为每个ev平均多于一(1)个na内容物分子,优选每个ev多于10个na内容物分子,甚至更优选每个ev多于100个na内容物分子。但是,在整个群体中,也可能存在不包含任何na内容物分子的ev,因此,本发明还可涉及包含每个ev平均少于一(1)个na内容物分子的ev群体。
[0068]
重要的是,现有技术通常仅将na内容物加载到一小部分ev中。例如,us14/502,494中描述的tamel系统似乎不能确保到定量加载到ev中,特别是外泌体中。这很可能表明,tamel系统导致单个ev的加载百分比为零到小于一。据tamel系统的发明人报告,外泌体中mrna分子的加载至多提高7倍,而与(i)融合蛋白中不含na结合结构域和/或na内容物分子中不含na结合结构域结合位点的ev;(ii)自身不含融合蛋白的ev;(iii)仅被动加载na内容物分子的未经工程化改造的ev;和/或(iv)给定内部na对照分子相比,本发明使mrna和其他na内容物分子的生产性加载典型提高至少10倍,优选至少25倍,但通常提高至少50倍和优选至少提高70倍,最优选100倍或更多倍。因此,本发明提供一种将更多的稳定和活性na内容物分子加载到给定ev群体中的方法,重要的是,与现有技术相比,本发明还可加载显著更高比例的ev,并且内容物na由pabp稳定,也可由tif稳定,这会增加na的半衰期,从而提高na的生物活性输送,在mrna的情况下,还会导致在mrna降解前更高效、更频繁地翻译mrna。在一个实施例中,本发明涉及ev群体,其中,至少5%、至少10%、至少20%、至少50%、至少70%、至少75%、至少80%、至少85%、至少90%和/或至少95%的ev包含至少一个所讨论na内容物分子的拷贝。现有技术并未试图改善na内容物的稳定性和半衰期,事实上,根本没有提及这一问题。此外,现有技术并未试图在mrna输送到受体细胞后改善mrna的翻译效率,并且无法解决该问题。
[0069]
在有利实施例中,融合多肽可进一步包含其他区域、结构域、序列和/或部分,使多肽具有各种特定功能。融合多肽中所含其他结构域的非限制性示例包括(i)多聚化结构域;(ii)连接肽;(iii)释放结构域;(iv)rna切割结构域,如p2a;(v)内体逃逸部分;(vi)蛋白酶特异性切割位点;(vii)内含肽和/或(viii)靶向部分。
[0070]
多聚化结构域使融合多肽实现二聚化、三聚化或任何高级多聚化,这会增加融合多肽到ev中的分选和转运,还有助于增加ev产生细胞的囊泡产量。连接肽可用于提高融合多肽构建体和相应多核苷酸构建体的灵活性,并且还可用于确保避免空间位阻并保持融合多肽的功能。释放结构域可包含在融合多肽构建体中,以便从原始融合多肽中释放特定部分或结构域。如果释放融合多肽部分会增加na内容物的生物活性输送,和/或融合多肽的特定功能对于较小的构建体具有更明显的作用,这会特别有利。合适的释放结构域可以是顺式切割序列(如内含肽)、光诱导单体或二聚体释放结构域(如kaede、kikgr、eosfp、tdeosfp、meos2、psmorange、gfp样dendra蛋白dendra和dendra2、cry2-cibn)等。na切割结构域还可有利地包含在融合多肽中,以触发na内容物切割。na切割结构域的非限制性示例包括核酸内切酶(如cas6、cas13)、工程化改造puf核酸酶、位点特异性rna核酸酶等。此外,
本发明的融合多肽还包含内体逃逸结构域,以驱动内体逃逸,并由此增强ev自身和ev na内容物分子的生物活性输送。
[0071]
另一个输送增强策略是将ev靶向细胞、组织和/或器官或其他身体区室。可以通过各种手段实现靶向,如使用靶向肽。此类靶向肽可以是长度为几个氨基酸到几百个氨基酸的任何地方,例如,在3-100个氨基酸、3-30个氨基酸、5-25个氨基酸之间的任何地方,如7个氨基酸、12个氨基酸、20个氨基酸等。本发明的靶向肽还可包括全长蛋白,如受体、受体配体等。此外,本发明所述的靶向肽还可包括抗体和抗体衍生物,如单克隆抗体、单链可变片段(scfv)、其他抗体结构域等。
[0072]
本发明使用编码本发明所述融合多肽的多核苷酸构建体。所述多核苷酸构建体可以各种不同的形式和/或在不同的载体中存在。例如,多核苷酸基本上可以呈线性、环状,和/或具有任何二级、三级和/或高级结构。此外,本发明还涉及包含多核苷酸的载体,例如,质粒等载体、任何环状dna多核苷酸(例如,质粒、微环、病毒,如腺病毒、腺相关病毒、慢病毒、mrna、裸病毒基因组和/或修饰mrna。可采用任何非病毒或病毒的方法,使用至少一个多核苷酸构建体,对ev产生细胞进行基因修饰,以将多核苷酸引入细胞中。适当的方法包括利用多阳离子试剂(如pei)、脂质转染试剂(如脂质体转染(rtm))、慢病毒转导、crispr-cas引导插入、flp-in系统、转座子系统、电穿孔、deae-葡聚糖转染法和磷酸钙转染法进行转染。对ev产生细胞中多核苷酸的引入方法的选择取决于各种参数,包括对细胞来源、多核苷酸载体的性质和特征(例如,如果载体是质粒或微环,或线性dna多核苷酸或mrna)以及所需合规和控制水平的选择。同样,可采用细胞系开发领域常用的各种技术,使形成稳定细胞系的ev产生细胞永生化,包括htert介导永生化、转录因子永生化、e1/e2永生化或其他病毒介导永生化技术等。
[0073]
本发明所述的多核苷酸构建体可进一步包含一个或多个位点或结构域,这些位点或结构域向多核苷酸赋予特定功能。例如,可通过稳定结构域(如其他polya尾或茎环)增强多核苷酸构建体的稳定性,并且多核苷酸构建体还可由特定的启动子控制,所述启动子可以是细胞类型特异性诱导型启动子、连接肽等。polya尾可插入cas6或cas13切割位点的上游,以切割保留稳定polya尾的mrna。
[0074]
本发明进一步涉及各种ev产生方法。此类方法可包括以下步骤:(i)将至少一个编码目标na内容物分子的多核苷酸构建体引入ev产生细胞中;(ii)将至少一个编码pabp的多核苷酸构建体引入ev产生细胞中;(iii)在ev产生细胞中表达由多核苷酸构建体编码的产物;以及(iv)从ev产生细胞中收集产生的ev,所述ev产生细胞包含na内容物分子和pabp。在某些实施例中,使用编码na内容物分子和pabp的单一多核苷酸构建体,而在其他实施例中,则使用一个以上的多核苷酸构建体。在不希望受到任何理论约束的情况下,可以推测,已将多核苷酸构建体(根据ev的目的和用途而瞬时或稳定地)引入其中的ev产生细胞会产生ev(如外泌体),所述ev包含由多核苷酸编码的pabp蛋白以及na内容物分子,所述na内容物分子由pabp蛋白稳定,并加载到ev产生细胞所分泌的ev中。在替代实施例中,pabp可来源于由相应多核苷酸构建体编码的融合多肽中。如上所述,此类融合蛋白通常包含至少一个外泌体多肽、至少一个na结合结构域(完整na结合蛋白的一个结构域或基本上一个完整na结合蛋白)以及至少一种pabp蛋白,其中,所述融合蛋白旨在通过na结合结构域和na之间的相互作用以及通过由pabp介导的na稳定作用增强所讨论的na内容物分子到ev的加载。
[0075]
在ev产生细胞分泌ev后,通常可从细胞培养基中收集ev,并且可在用于特定用途前进行进一步的纯化。单个ev通常包含na内容物分子的若干拷贝,但单个ev还可包含多于一种类型的na药物内容物分子。作为包含多于一种类型的na药物内容物的ev的非限制性示例,单个ev(即,单一类型ev的群体)可包含mrna药物内容物分子和grna na药物内容物分子。在优选实施例中,所述方法进一步包括引入和表达编码外泌体蛋白-na结合结构域融合蛋白和/或tif的多核苷酸构建体。
[0076]
在进一步的方面,本发明涉及包含(i)本发明所述的至少一个多核苷酸构建体和/或(ii)本发明所述的至少一个多肽构建体的细胞。此外,本发明还涉及包含本发明所述的多核苷酸构建体、多肽构建体和ev的细胞。ev产生细胞可以下列形式存在:原代细胞、细胞系、存在于多细胞生物中的细胞或基本上任何其他类型的细胞来源和ev产生细胞材料。术语“源细胞”、“ev源细胞”、“亲本细胞”、“细胞来源”、“ev产生细胞”、“产生细胞”或任何其他类似术语均应理解为涵盖在适当条件下可产生ev的任何细胞,例如,在悬浮培养或贴壁培养或任何其他类型的培养系统中。本发明所述的源细胞还可包括体内产生外泌体的细胞。可从一系列细胞和细胞系中选择本发明所述的源细胞,这些细胞和细胞系可在悬浮或贴壁中生长,并适应悬浮生长。对于本发明目标细胞而言,典型的非限制性示例包括间充质干细胞或基质细胞(可从骨髓、脂肪组织、华通氏胶、围产期组织、胎盘、牙蕾、脐带、脐带血、皮肤组织等获得)、成纤维细胞、羊膜细胞,更具体地说,羊膜上皮细胞、髓样抑制细胞、m2极化巨噬细胞、脂肪细胞、内皮细胞、成纤维细胞等。特别关注的细胞系包括人脐带内皮细胞(huvec)、人胚肾(hek)细胞(如hek293细胞、hek293t细胞、无血清hek293细胞、悬浮hek293细胞)、内皮细胞系(如微血管内皮细胞或淋巴内皮细胞)、红细胞、红系祖细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术或从胎盘获得的任何细胞、气道上皮细胞或肺泡上皮细胞、成纤维细胞、内皮细胞、上皮细胞等。此外,b细胞、t细胞、nk细胞、巨噬细胞、单核细胞、树突细胞(dc)等免疫细胞也属于本发明适用范围,并且基本上能够产生ev的任何类型的细胞也包括在本文中。通常,ev基本上可来自任何细胞来源,包括原代细胞来源或永生化细胞系。ev源细胞可以是任何胚胎、胎儿和成体干细胞类型,包括诱导多能干细胞(ipsc)和通过任何方法衍生的其他干细胞。
[0077]
如上所述,在优选实施例中,使用至少一个编码(i)pabp和(ii)na内容物的多核苷酸构建体稳定地转染和/或转导本发明的ev产生细胞,也可使用至少一个编码(iii)包含na结合结构域的融合多肽和/或(iv)tif的多核苷酸构建体转染和/或转导细胞。在高度优选的实施例中,将ev产生细胞暴露于克隆选择方案下,以允许单细胞克隆的克隆选择。因此,在高度优选的实施例中,本发明涉及ev产生细胞的单细胞克隆种群,所述ev产生细胞进行转染和/或转导,以产生包含pabp(可以融合多肽(如cd63-pufeng)的形式存在)和na内容物分子的ev。可通过有限稀释法、单细胞分选和/或使用克隆柱分离单个细胞或细胞系开发领域已知的任何其他技术来获得单个克隆。
[0078]
在进一步的方面,本发明涉及向细胞内输送至少一个na内容物分子的体外方法。可有利地在体外和/或离体执行此类方法。所述方法可包括以下步骤:使靶细胞与至少一种本发明所述的ev接触,或更常见地是与本发明所述的ev群体接触。此外,本发明所述的na内容物分子输送方法还可包括将编码本文所述na内容物分子、pabp和融合多肽(可选)的多核苷酸引入存在于任何生物系统(如人类)中的细胞中。
[0079]
在其他方面,本发明涉及包含以下一种或多种组分的药物合成物:(i)至少一种本文所述的ev;(ii)至少一种本文所述的细胞;和/或(iii)至少一种本文所述的ev群体,其通常与可药用赋形剂、载体和/或稀释剂或类似物一起配制。此外,本发明还涉及:(i)至少一种本文所述的ev;(ii)至少一种本文所述的细胞;和/或(iii)至少一种本文所述的ev群体;以及(iv)上述药物合成物(药用)。更具体地说,本发明涉及在预防和/或治疗和/或减轻各种疾病中的用途。非限制性的疾病和症状示例包括以下非限制性示例:克罗恩病、溃疡性结肠炎、强直性脊柱炎、类风湿性关节炎、多发性硬化、全身性红斑狼疮、结节病、特发性肺纤维化、牛皮癣、肿瘤坏死因子(tnf)受体相关周期性综合征(traps)、白介素1受体拮抗剂缺乏症(dira)、子宫内膜异位症、自身免疫性肝炎、硬皮病、肌炎、中风、急性脊髓损伤、血管炎、格林-巴利综合征、急性心肌梗塞、ards、败血症、脑膜炎、脑炎、肝衰竭、非酒精性脂肪性肝炎(nash)、非酒精性脂肪肝(nafld)、肾衰竭、心力衰竭或任何急性或慢性器官衰竭以及相关潜在病因、移植物抗宿主病、杜氏肌营养不良症和其他肌营养不良症、尿素循环障碍(如n-乙酰谷氨酸合成酶缺乏症、氨甲酰磷酸合成酶缺乏症、鸟氨酸转氨甲酰酶缺乏症)、瓜胺酸血症(缺乏精氨基琥珀酸合酶)、精氨基琥珀酸尿症(缺乏精氨基琥珀酸裂解酶)、精氨酸血症(缺乏精氨酸酶)、高鸟氨酸血症-高血氨症-同型瓜氨酸尿症(hhh)综合征(缺乏柠檬素、天冬氨酸-谷氨酸转运蛋白)、赖氨酸尿蛋白不耐受症(y+l氨基酸转运蛋白1突变)、乳清酸尿症(缺乏尿苷单磷酸合成酶umps)、所有溶酶体贮积症(如i型、ii型和/或iii型戈谢病、法布瑞氏症、mps i、ii(亨特综合征)iii和iv、尼曼-匹克病a型、b型和c型、庞贝病、胱氨酸病等)、神经退行性疾病(包括阿尔茨海默病、帕金森病、gba相关帕金森病、亨廷顿病和其他三核苷酸重复相关疾病、痴呆、als)、癌性恶病质、厌食症、2型糖尿病和各种癌症。几乎所有类型的癌症都是本发明的相关疾病靶标,例如,急性淋巴细胞白血病(all)、急性髓系白血病、肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、小脑或大脑基底细胞癌、胆管癌、膀胱癌、骨瘤、脑干胶质瘤、脑癌、脑瘤(小脑星形细胞瘤、脑星形细胞瘤/恶性胶质瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层瘤、视觉通路和下丘脑胶质瘤)、乳腺癌、支气管腺瘤/类癌、伯基特淋巴瘤、类癌瘤(儿童、胃肠道)、未知原发灶不明肿瘤、中枢神经系统淋巴瘤、小脑星形细胞瘤/恶性胶质瘤、宫颈癌、慢性淋巴细胞白血病、慢性髓系白血病、慢性骨髓增殖性疾病、结肠癌、皮肤t细胞淋巴瘤、促结缔组织增生性小圆细胞瘤、子宫内膜癌、室管膜瘤、食道癌、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌(眼内黑色素瘤、视网膜母细胞瘤)、胆囊癌、胃癌、胃肠道类癌瘤、胃肠道间质瘤(gist)、生殖细胞瘤(颅外、性腺外或卵巢)、妊娠滋养细胞瘤、胶质瘤(脑干胶质瘤、脑星形细胞瘤、视觉通路和下丘脑胶质瘤)、胃类癌、毛细胞白血病、头颈癌、心脏癌、肝细胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼内黑色素瘤、胰岛细胞癌(内分泌胰腺)、卡波西肉瘤、肾癌(肾细胞癌)、喉癌、白血病(急性淋巴细胞白血病(也称为急性淋巴性白血病)、急性髓系白血病(也称为急性骨髓性白血病)、慢性淋巴细胞白血病(也称为慢性髓系白血病)、慢性骨髓性白血病(也称为慢性髓系白血病)、毛细胞白血病)、唇和口腔癌、脂肪肉瘤、肝癌(原发性)、肺癌(非小细胞、小细胞)、淋巴瘤、aids相关淋巴瘤、伯基特淋巴瘤、皮肤t细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、成神经管细胞瘤、默克尔细胞癌、间皮瘤、原发灶隐匿转移性鳞状颈癌、口腔癌、多发性内分泌瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样肉芽肿、骨髓增生异常/骨髓增殖性疾病、骨髓性白血病、慢性髓系白血病(急性、慢性)、骨髓瘤、鼻腔和鼻
窦癌、鼻咽癌、神经母细胞瘤、口腔癌、口咽癌、骨肉瘤/骨恶性纤维组织细胞瘤、卵巢癌、卵巢上皮癌(表面上皮间质瘤)、卵巢生殖细胞瘤、卵巢低度恶性潜能肿瘤、胰腺癌、胰岛细胞癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤、松果体生殖细胞瘤、松果体母细胞瘤和幕上原始神经外胚层瘤、垂体腺瘤、胸膜肺母细胞瘤、前列腺癌、直肠癌、肾细胞癌(肾癌)、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤(尤文肉瘤家族肿瘤、卡波西肉瘤、软组织肉瘤、子宫肉瘤)、西泽里综合征、皮肤癌(非黑色素瘤、黑色素瘤)、小肠癌、鳞状细胞癌、鳞状颈癌、胃癌、幕上原始神经外胚层瘤、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管移行细胞癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、华氏巨球蛋白血症,和/或肾母细胞瘤。
[0080]
可通过以下各种不同的给药途径向人类受试者或受试动物施用本发明所述的ev:耳、颊、结膜、皮肤、牙齿、电渗、子宫颈内、鼻窦内、气管内、肠内、硬膜外、羊膜外、体外、血液透析、浸润、间质、腹腔内、羊膜内、动脉内、关节内、胆道内、支气管内、囊内、心内、软骨内、尾内、海绵窦内、腔内、脑内、脑室内、脑池内、角膜内、冠内(牙齿)、冠状动脉内、海绵体内、皮内、椎间盘内、导管内、十二指肠内、硬膜内、表皮内、食道内、胃内、牙龈内、回肠内、病灶内、管腔内、淋巴管内、髓内、脑膜内、肌内、眼内、卵巢内、心包内、腹膜内、胸膜内、前列腺内、肺内、窦内、椎管内、滑膜内、腱内、睾丸内、鞘内、胸腔内、小管内、肿瘤内、鼓室内、子宫内、血管内、静脉内、静脉推注、静脉滴注、心室内、膀胱内、玻璃体内、离子电渗、冲洗、喉、鼻腔、鼻饲、封闭敷裹法、眼、口服、口咽、其他、胃肠外、经皮、关节周围、硬膜外、神经周、牙周、直肠、呼吸(吸入)、眼球后、软组织、蛛网膜下腔、结膜下、皮下、舌下、粘膜下、局部、经皮、经粘膜、经胎盘、经气管、经鼓膜、输尿管、尿道和/或阴道给药和/或上述给药途径的任意组合,此类给药途径通常取决于要治疗的疾病和/或ev、所讨论的na内容物分子或ev群体本身的特征。
[0081]
示例
[0082]
材料和方法
[0083]
构建体设计和克隆
[0084]
为了从哺乳动物表达载体中表达pabp,已设计两种不同类型的dna构建体。第一种构建体涉及融合到两个ha标签的pabp的orf克隆,第二种构建体涉及通过p2a从融合到rna结合结构域的外泌体多肽中分离的pabp的orf克隆。翻译后,p2a序列会发生切割反应,产生不同的多肽、融合到rna结合结构域的外泌体蛋白和pabp。这样就可以从同一质粒中表达两种目标蛋白。所选载体为fc5501-a,这是一种来自phic31整合酶系统(sbi)的供体载体,在存在表达phic31整合酶的质粒的情况下对此质粒进行共转染时,允许对克隆蛋白进行瞬时转染分析,并在保持稳定的前提下,将插入物整合至基因组中。orf通常通过合成产生。简而言之,根据制造商说明书(neb),对于ha-pabp构建体,使用酶ecori和mlul消化插入物和质粒。根据制造商说明书(neb),使用t4连接酶将限制性纯化dna片段连接在一起。通过氨苄青霉素补充板上的细菌转化,选择成功的连接事件。对几个克隆进行限制性分析,并将包含适当尺寸插入物的两个克隆送去进行测序,以验证序列是否正确。根据制造商说明书,通过“maxi-prep”产生以下实验所需数量的质粒。
[0085]
由于含p2a片段的插入物尺寸较大,采用两个连续步骤进行克隆。首先,使用ecori和nhel以及受体质粒切割包含融合到rna结合结构域的外泌体多肽的合成片段。连接后,对
成功的连接事件进行限制性分析,以包含正确尺寸的插入物,并将其送去进行测序。然后,使用nhel和mlul以及编码p2a_pabp的第二合成片段切割包含正确序列的质粒。采用上述正确克隆的相同连接和选择策略,产生供以下实验使用的大量质粒。
[0086]
已结合几种外泌体多肽(如cd81、cd63、cd9、同线蛋白、多配体蛋白聚糖、alix、cd133等),评估了各种na结合结构域及其变体(如puf、突变puf、pufx2、cas6、突变cas6、cas13、突变cas13、ms2等)。orf通常通过合成产生,并被克隆到哺乳动物表达载体psf-cag-amp中。简而言之,根据制造商说明书(neb),使用酶notl和saii消化合成的dna和载体。根据制造商说明书(neb),使用t4连接酶将限制性纯化dna片段连接在一起。通过氨苄青霉素补充板上的细菌转化,选择成功的关联事件。根据制造商说明书,通过“maxi-prep”产生用于转染的质粒。
[0087]
细胞培养、转染和ev摄取
[0088]
细胞培养
[0089]
根据实验设计和测定,在常规2d细胞培养中进行瞬时转染并产生ev。在其他情况下,使用sbi的phic31整合系统构建稳定的细胞系。
[0090]
在瞬时转染的情况下,hek293细胞稳定表达目标mrna,并稳定表达或不表达融合到rna结合结构域的外泌体蛋白(或无结合对照),将此类细胞接种到15cm的培养皿中,并按照atcc的建议在含血清的dmem中放置过夜。第二天,根据制造商说明书,使用lipofectamine2000及相应质粒dna(表达pabp,必要时,结合表达融合到rna结合结构域的外泌体蛋白(或无结合对照)的质粒)瞬时转染细胞。简而言之,在室温下,在opti-mem中使用所需量的lipofectamine2000孵育质粒dna 5分钟。孵育后,将脂质体-dna复合物轻轻地加入细胞中。转染24小时后,用opti-mem代替含血清的dmem,再孵育48小时,然后继续培养基和细胞收获操作。
[0091]
为了产生表达不同外泌体多肽(融合到rna结合结构域或无p2a和pabp结合对照)组合的稳定细胞系或表达ha2-pabp的质粒,在存在表达phic31整合酶的其他质粒的情况下,使用上述相应质粒dna转染hek293细胞。转染48小时后,对细胞进行传代培养,并将其接种到6孔板上,然后通过各种量的相应抗生素进行处理,选择将插入物整合到基因组中的细胞。在2-3周的选择后,收集细胞,并通过蛋白免疫印迹法和/或流式细胞术分析整合蛋白的表达情况。除hek293细胞之外,可对相同方案略作修改,然后将其用于悬浮hek293细胞、无血清hek293细胞、华通氏胶msc、骨髓应衍生msc、羊膜上皮细胞、胎盘衍生msc及其他细胞来源的工程化改造和开发。
[0092]
ev纯化
[0093]
根据实验,hek293t瞬时转染48小时后或稳定细胞系接种48小时后,将培养基更换为opti-mem,以促进产生ev。48小时后,收获条件培养基,并采用各种方法分离ev,通常采用过滤法(如tff)、尺寸排阻色谱法或超速离心法和/或珠洗脱液相色谱法等的组合。通常将含ev的培养基以700g离心力差速离心5分钟,然后以2000g离心力差速离心10分钟,分别去除细胞和碎片。然后,进行0.22μm过滤,去除剩余的任何较大杂质。在以100,000g离心力完成90分钟的超速离心周期后,去除上清液,并将获得的团块重悬于经0.22μm过滤的pbs 1x中。通常以100,000g离心力进行第二轮的90分钟离心操作,然后将获得的ev团块重悬于200μl经0.22μm过滤的pbs中。
[0094]
如果需要大量的条件培养基,则在差速离心和0.22μm过滤后,使用带有100kda截止过滤器的vivaflow 50r切向流(tff)设备(sartorius)对条件培养基进行渗滤和浓缩。随后,将预浓缩的培养基加载到珠洗脱色谱柱(hiscreen(rtm)或hitrap(rtm)capto core 700色谱柱,通用电气医疗集团生命科学部)上,所述色谱柱连接至akta pure 25(rtm)色谱系统的aktaprime(rtm)plus(通用电气医疗集团生命科学部)。根据制造商说明书,选择用于柱平衡、样品加载和柱清洗程序的流速设置。根据uv吸收色谱图采集样品。
[0095]
摄取测定
[0096]
例如,将105个huh7细胞接种到含血清dmem的24孔板中。接种24小时后,移除此培养基,并更换为500ul含所需量hek293 ev(范围:10
10-108)的无血清opti-mem。还向一个不含细胞的额外孔中加入含ev的培养基,以解释加载到ev中的蛋白本底情况。处理16小时后,收集上清液,在pbs 1x中洗涤细胞,并使用胰蛋白酶分离细胞。将每种条件下的上清液和pbs洗涤液合在一起,并使用countess ii fl自动细胞计数器对细胞进行计数并评估细胞活性。
[0097]
然后,从细胞中提取rna,并通过rt-qpcr分析是否存在目标rna。通过蛋白免疫印迹法和/或荧光素酶分析进行蛋白表达分析。
[0098]
测定和分析
[0099]
蛋白免疫印迹法是一种十分便捷的分析方法,用于评估ev中的蛋白富集情况和细胞表达情况。简而言之,根据制造商说明书(英杰公司,novex page 4-12%凝胶)进行sds-page。根据制造商说明书,使用pierce bca蛋白浓度测定试剂盒评估细胞裂解液的蛋白浓度,并在凝胶中加入40ug。通常加载1x10
10
个ev。根据制造商说明书(immobilon(rtm),英杰公司),将sds-page凝胶中的蛋白转移到pvdf膜上。根据供应商说明书,在室温下,可在odyssey封闭缓冲液(licor公司)中封闭膜1小时,并使用一级抗体进行探测。cd63、pabp、ha、微管蛋白和alix的一级抗体均购自abeam公司。nanoluc抗体由promega公司慷慨提供。根据制造商说明书,使用了licor公司的二级抗体。分子探针在680nm和800nm波长下可视化。
[0100]
为了确定ev的数量和大小,使用配备分析软件的zetaview pmx-120(颗粒矩阵)仪器进行纳米颗粒跟踪分析(nta)。或者,使用配备分析软件的nanosight(rtm)仪器进行纳米颗粒跟踪分析(nta)。为了在nanosight(rtm)上进行记录,使用13级或15级摄像机级别以及所有采集后设置的自动功能。经常使用电子显微镜和荧光显微镜来验证和评估ev的形态和大小。
[0101]
使用direct-zol
tm
rna microprep试剂盒(zymo研究公司),从ev中提取rna,以分析加载情况。为了从细胞中提取rna,首先使用tri试剂(赛默飞世尔公司)使细胞裂解。稳定后,加入氯仿,分离总rna。将含rna的水相与相同体积的100%乙醇混合,然后,根据制造商的方案(zymo研究公司),使用direct-zol rna miniprep试剂盒提取rna。为了去除基因组和质粒dna的所有痕迹,执行dnase处理步骤。最后,使用分光光度计对rna进行定量,并使用反转录试剂盒“高容量cdna反转录试剂盒”(应用生物系统公司)以及随机引物oligo dt或转录子特异性引物,将100ng的rna用于反转录反应中,以产生cdna。根据制造商说明书,使用powerup sybr green预混液(赛默飞世尔科技公司)和steponeplus实时荧光定量pcr仪(赛默飞世尔科技公司)以及2ng新合成的cdna进行定量pcr。
[0102]
使用每个转录扩增子的标准曲线,计算靶转录子每个细胞/ev的绝对拷贝数。
[0103]
在荧光素酶测定中,使用50ul的被动裂解缓冲液1x(promega公司)裂解细胞团块,并使用荧光素酶测定系统进行发光测量。结合细胞裂解液,评估细胞培养上清液、pbs洗涤液以及ev上清液的发光情况。
[0104]
示例
[0105]
示例1
[0106]
在常规组织培养瓶中培养骨髓衍生msc,并采用pei转染法进行瞬时转染,以加载和表达mrna内容物分子和融合多肽构建体。图2显示了从编码nanoluc(rtm)和p21的mrna内容物分子的bm-msc中获得的ev中的加载情况。通过对包含cd63作为外泌体多肽和puf或cas6作为na结合结构域的融合多肽构建体进行工程化改造,并结合pabp作为融合蛋白构建体的一部分或编码为单独蛋白,主动加载na内容物分子。此实验还包括na内容物分子上不同数量的na结合结构域结合位点,即0个、3个和6个结合位点,将其插入编码区的3'和/或5’旁侧的不同位置中。
[0107]
使用tff和sec的序列组合纯化msc-ev。仅外泌体多肽cd63的表达不会导致将任何mrna加载到ev中(图2中的图右列)。包含puf的融合多肽的表达(左列:cd63的n端和c端侧接有两个puf结构域,即共4个puf构建体)(左起第二列:cd63的n端和c端侧接有一个puf结构域)和突变的cas6(右起第二列)在ev源细胞中表达时确实导致nanoluc(rtm)和p21 mrna显著加载mrna。加载nanoluc(rtm)总体上比加载p21更为有效,每个ev最多可加载约45个mrna拷贝。
[0108]
示例2
[0109]
在nanoluc(rtm)mrna进行hek ev介导输送后,在靶huh7细胞中nanoluc(rtm)作为报告系统的表达情况。稳定转导hek293t细胞,以表达各种融合多肽构建体,从而将报告基因nanoluc(rtm)na内容物加载到ev中。nanoluc(rtm)na内容物分子经工程化改造,包含na结合结构域(包含融合多肽构建体)的0个、3个或6个结合位点,在这种情况下,包括pufx2-cd63-pufx2(两个puf na结合多肽插入外泌体多肽cd63的n端和c端)、puf-cd63-puf和cas6-cd9-cas6(图3)。
[0110]
在基于tff(结合珠洗脱lc)的hek衍生ev纯化后,以最佳浓度将ev加入hek细胞中,在此测定中,含huh7靶细胞的6孔板的每个孔中各包含10^7个ev。图3的y轴显示了根据μg蛋白归一化的相对光(发光)单位(rlu),表明随着使用不同融合多肽构建体的结合位点数量的增加,输送和/或翻译增强。因此,图3显示,本发明的ev能够向细胞输送生物活性mrna,然后,这些细胞将成功翻译mrna。这是本发明相对于现有技术的一个显著优势,现有技术只能将rna加载到ev中,但不能将这些rna输送到靶细胞胞质溶胶进行主动翻译。
[0111]
示例3
[0112]
图5显示,当使用ha-pabp和cd63-pufeng瞬时转染hek293细胞并且hek293细胞稳定表达nanoluc mrna时,pabp和融合蛋白cd63-pufeng存在于细胞裂解液以及从条件培养基中纯化的细胞外囊泡中。
[0113]
在图5a中,使用包含pabp(n端包含两个ha标签)cdna的pcdna3质粒、包含cd63-pufeng cdna的plex质粒以及缺少pufeng核酸结合结构域的对照质粒瞬时转染相同量的hek293细胞裂解液。所示蛋白免疫印迹法使用pabp、cd63、nanoluc和微管蛋白的抗体(用作
加载对照)进行免疫印迹分析。图5a显示,为应对使用pabp构建体的细胞转染,pabp过表达,并且当这种构建体转染到细胞中时,cd63-pufeng融合蛋白也在细胞中表达。从孔4中可以明确看出,在相同细胞类型中,pabp和cd63-pufeng均可能过表达。
[0114]
图5b显示了从含瞬时转染细胞(上述细胞)的条件培养基中纯化的相同数量的ev,其中,使用pabp、cd63、nanoluc和alix的抗体(用作加载对照)对这些细胞进行了免疫印迹分析。图5b的结果表明,上述使用不同构建体转染的细胞会产生ev,所述ev也包含与产生它们的细胞相同的过表达水平的pabp和/或cd63-pufeng。
[0115]
示例4-存在pabp时,ev中mrna水平增加的证据
[0116]
图6显示,ev产生细胞中pabp的过表达会增加加载到ev中的mrna分子数量。发明人观察到,当pabp过表达时,每个产生细胞的mrna分子数量增加180%(数据未显示)。然后,从含hek293t稳定细胞系的条件培养基中纯化来自这些产生细胞的ev,hek293t稳定细胞系表达nanoluc mrna(3'utr包含pufeng相互作用位点),使用融合到c端rna结合结构域pufeng的工程化改造外泌体蛋白cd63对此类细胞进行瞬时转染,并使用表达ha2-pabp的质粒进行-/+瞬时转染。ev纯化后,提取rna,并使用oligodt引物进行反转录。然后,利用qpcr绝对定量法以及标准曲线,对nanoluc mrna的5’端区域的相应扩增子进行定量。
[0117]
图6中的表格显示了检测到的每1*106个ev的nanoluc mrna分子数量的百分比增加量。根据存在pabp时加载到ev中的分子数量与不存在pabp时加载到ev中的分子数量之间的比率,计算倍数富集情况,对于这两种情况,分别称为结合条件(cd63-pufeng)和无结合对照(cd63-ms2)。pabp可提高nanoluc的加载效率。
[0118]
图6显示,单独存在的pabp会导致每个ev的mrna分子数量增加300%(即,稳定仅通过被动加载方式加载的mrna),而pabp结合cd63-pufeng加载构建体会导致加载到产生细胞所产生的ev中的mrna分子数量增加1000%。pabp可稳定mrna,从而增加产生细胞中mrna的半衰期,存在pabp时,加载到ev中的mrna将增加,同时有可能对融合蛋白加载构建体产生额外的有益作用。
[0119]
示例5-受体细胞中mrna翻译的证据
[0120]
图7显示,存在pabp时,向huh7受体细胞(使用加载mrna的ev进行处理)输送的nanoluc mrna分子数量更多,并且因所输送mrna分子的翻译增加致使细胞裂解液中检测到的rlu增加。
[0121]
使用含nanoluc mrna+/-pabp的ev进行了图7所示的摄取实验。y轴显示了nanoluc蛋白在翻译时所释放的总rlu(相对发光单位),将其归一化至细胞裂解液中的μg蛋白以及在ev中测得的总rlu。从huh7中提取rna,并使用oligodt引物进行反转录。然后,利用qpcr绝对定量法以及标准曲线,对nanoluc mrna 5’端区域的相应扩增子进行定量。结果表明,当pabp作为mrna的稳定剂时,向受体细胞输送的mrna数量将显著增加,同时可能对融合蛋白加载构建体产生额外作用,这表明,pabp不仅稳定产生细胞中的mrna以及所产生的ev中携带的mrna,而且在ev进入受体细胞并向受体细胞释放mrna后稳定mrna。
[0122]
此外,rlu数据表明,受体细胞中检测到的mrna数量增加,导致受体细胞中内容物mrna的翻译水平增加。这证明了本发明的能力,即,通过利用pabp,能够向受体细胞输送更多的生物活性mrna分子,并且所输送mrna的稳定性增加,导致受体细胞中内容物mrna向所需治疗性蛋白的翻译水平显著增加。
[0123]
图8显示了重复进行图7所示摄取实验的结果(除在10倍稀释下输送ev之外,与示例5所述方法相同)。为了更清晰地显示添加pabp对所输送mrna的翻译水平的影响,进行了稀释。稀释应用于受体细胞的ev样本,可更清晰地区分受体细胞中的mrna翻译水平,因为这样可防止新翻译的nanoluc信号被随mrna被动加载到ev中的nanoluc蛋白饱和。存在pabp时,向huh7受体细胞输送的nanoluc mrna分子数量更多,并且因所输送mrna分子的翻译增加从而使细胞裂解液中检测到的rlu增加(7倍)。
[0124]
与图7中的数据相同,图8中的rlu数据表明,受体细胞中检测到的mrna数量增加,导致受体细胞中内容物mrna的翻译水平增加。这证明了本发明的能力,即,通过利用pabp,能够向受体细胞输送更多的生物活性mrna分子,并且所输送mrna的稳定性增加,导致受体细胞中内容物mrna向所需治疗性蛋白的翻译水平显著增加。
[0125]
示例6-被动加载核酸稳定的证据
[0126]
此外,图6-8中的数据表明,存在pabp也会改善被动加载mrna的加载情况。图6显示,仅单独存在pabp(不使用puf等na结合蛋白,即,“无结合”示例)会导致每个ev的mrna分子数量增加300%。根据存在pabp时加载到ev中的分子数量与不存在pabp时加载到ev中的分子数量之间的比率,计算倍数富集情况。在不借助于外泌体蛋白-na结合结构域融合蛋白的情况下,存在pabp时,nanoluc的加载效率更高。
[0127]
图7和图8中的“无结合”数据表明,由所加pabp稳定的被动加载mrna导致受体细胞中mrna的翻译水平增加,这表明添加pabp会增加被动加载mrna的生物活性输送。图7和图8显示,将mrna被动加载到ev中时(不使用na结合蛋白),这些分子中pabp的存在能够稳定通过这种被动加载方式加载的mrna。特别是,图8中的数据表明受体细胞中的翻译水平增加了4倍。在mrna被动加载到ev中以及输送到受体细胞时,pabp的存在会稳定mrna,从而增加产生细胞中mrna的半衰期。
[0128]
示例7-外源性加载核酸的稳定
[0129]
图6-8中的数据还表明,可通过增加其稳定性来改善外源性加入ev中的核酸的输送。
[0130]
本发明涉及一种ev,所述ev包含至少一个polya结合蛋白(pabp)或其一个片段或结构域以及至少一个na内容物分子(包含一段连续腺嘌呤核苷酸),其中,所述na内容物分子外源性地加载到ev中。所述na内容物分子可天然包含一段连续腺嘌呤核苷酸(即polya区),或可将polya区引入所述na内容物分子中,以增加其稳定性。
[0131]
图6-8显示,可稳定mrna或包含polya尾的任何其他na内容物,所述polya尾外源性地加入ev中,因此可使用pabp来稳定外源性na内容物,从而输送更多的na内容物(处于改善生物活性状态)。
[0132]
如上所述(有关示例6),图6-8中的“无结合”数据表明,存在pabp也能稳定游离na内容物(即,未与rna结合蛋白结合的内容物)。图6-8中的“无结合”数据表明,由所加pabp稳定的被动加载mrna导致每个ev的mrna分子数量增加300%,也导致受体细胞中mrna的翻译水平增加,这表明添加pabp会增加被动加载mrna的生物活性输送。图7-8显示,将mrna被动加载到ev中时(不使用rna结合蛋白),这些分子中pabp的存在能够稳定通过这种被动加载方式加载的mrna。图8中的数据表明受体细胞中的翻译水平增加了4倍。在mrna加载到ev中以及输送到受体细胞时,pabp的存在会稳定mrna,从而增加mrna的半衰期。
[0133]
这些数据表明,可采用包括以下步骤的方法,产生加载稳定na内容物的ev:a)从产生细胞系中产生ev;b)通过任何已知方法纯化ev;c)产生并纯化包含一段连续腺嘌呤核苷酸的na内容物,或合成包含一段连续腺嘌呤核苷酸的人工na内容物;d)将这种外源性na内容物与一定量的pabp混合,以稳定na内容物;以及e)通过任何已知方法将所述稳定na内容物外源性地加载到ev中。已知加载方法包括电穿孔、使用转染试剂(如脂质体转染(rtm)等阳离子转染剂)转染或通过细胞穿透肽(cpp)加载。
