1.本发明涉及“抗鸡传染性法氏囊病毒的重链高亲和力抗体的制备和应用”属于生物技术领域。
背景技术:
2.鸡传染性法氏囊病(infectious bursal disease,ibd)是由鸡传染性法氏囊病毒(infectious bursal disease virus,ibdv)引起的一种急性、高度接触性传染病。ibdv主要侵害3-12周龄的雏鸡和青年鸡,损伤鸡的中枢免疫器官——法氏囊,具有传播速度快、传染性强、感染率及死亡率均高的特点。该病目前在全球范围内均有分布,是养禽业最重要疾病之一,并且因免疫失败而造成的经济损失巨大。
3.目前,预防ibd的主要方法是接种疫苗。但常用的预防ibd的疫苗是中等毒力疫苗,会对接种鸡的法氏囊造成不同程度的损伤,导致免疫抑制,从而可增强机体对其它病原体的易感性并且降低对其它疫苗的反应性。所以很多鸡场,特别是小型鸡场选择卵黄抗体来预防和治疗ibd,但是,卵黄抗体除了产品质量难控制、其水平和垂直传播疾病的问题也受到越来越多的关注。在ibd的预防工作中,迫切需要一种可以预防和治疗ibd的本动物源的重链高亲和力的抗体。随着基因工程技术的发展,使基因工程抗体技术应运而生。目前,本动物重链抗体产品在兽医领域尚属空白,本发明旨在研制出具有预防和治疗ibd的鸡源重组重链高亲和力的抗体。
4.重链全长抗体含有完整的恒定区区域,在生物表达过程中经过细胞器严格的加工修饰才能使其具有高亲和力以及与抗原特异性结合能力,因此,对其生产从质和量上的要求就更加的严格,表达系统的选择也至关重要。原核生物不含蛋白加工修饰的众多细胞器,因此,大肠杆菌表达系统只可以用于生产体积小、结构简单、不需要糖基化的抗体片断如fab、fab'、scfv等;低等真核生物表达系统,如酵母及丝状真菌,可用于全长抗体的生产,但其糖基化类型与哺乳动物相比存在差异,如酵母糖基化类型为多麦芽糖类型,该类型糖蛋白抗体半衰期较短、生理活性有限甚至对人体有毒性。在蛋白修饰的系统中最接近人体的是哺乳动物表达系统,该系统可以对蛋白进行适当的折叠、装配和翻译后修饰,在临床应用中占主导地位,目前,中国仓鼠卵巢细胞(chinese hamster ovary cells,cho cells)是最理想的真核表达宿主,通过该系统表达的蛋白在构型和构象上更接近于天然蛋白,是重组糖基化蛋白生产的首选体系。
5.目前,获fda批准的抗体药物中许多是由cho细胞生产的,cho-k1细胞是可以悬浮生长的谷氨酰胺合成酶(gs)缺陷型细胞,因此,转染后的cho细胞可运用共扩增基因进行筛选,即在表达载体上游加入gs基因作为筛选标记,同时利用gs抑制物甲硫胺酸亚砜(l-methionine sulfoxide,msx)进行加压筛选,随培养基中msx浓度的逐渐增加,gs基因带动与之串联在一起的外源基因共同转录,使目的基因的转录效率增加,从而实现外源基因的高效表达。由于gs筛选标记不能够直观的监测及分选阳性细胞,因此,本发明在载体上引入增强型绿色荧光蛋白(egfp)基因,egfp是gfp的突变体,具有更高的荧光强度,在488nm波长
光激发下可产生绿色荧光,从而通过流式细胞仪进行检测和分选。
6.本发明将本实验室已筛选出的一株本动物源的具有高亲和力和中和活性的抗ibdv的scfv抗体中的重链可变区构建成重链全长抗体,转染cho细胞,筛选出能够稳定表达抗ibdv的鸡源重组重链高亲和力抗体的细胞株。本研究获得了抗鸡传染性法氏囊病毒的本动物源重链高亲和力的重组抗体,通过动物实验表明重链抗体具有预防和治疗鸡传染性法氏囊病的效果。本发明为兽医领域研制本动物源重链治疗性抗体建立了平台,为推动动物治疗性抗体的产业化奠定了基础。
技术实现要素:
7.本发明的目的是提供抗鸡传染性法氏囊病毒的重链高亲和力抗体的制备和应用。
8.本发明提供了抗鸡传染性法氏囊病毒的重链高亲和力抗体基因。
9.本发明提供了真核表达载体的重链高亲和力全长抗体质粒。
10.本发明提供了可以稳定,高效表达抗鸡传染性法氏囊病毒的重链高亲和力抗体的cho-k1单克隆细胞株,由不含内毒素的peedual-h-ires-egfp-h质粒转染进入cho-k1细胞株,并通过甲硫胺酸亚砜加压和流式细胞仪多次筛选、流式细胞仪分选单克隆得到。得到的抗鸡传染性法氏囊病毒的重链高亲和力抗体能够中和ibdv,达到预防和治疗ibd的效果。
附图说明
11.图1为转染后的cho-k1细胞
12.图2为转染后cho-k1阳性细胞的筛选
13.图3为三筛后的cho-k1细胞
14.图4为单克隆细胞阳性率检测
15.图5为h抗体的elisa检测
具体实施方式
16.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。cho-k1细胞购买于细胞公司。胎牛血清,imdm培养基,dmem培养基,无血清mem培养基,opticho无血清培养基:gibco公司。l-glutamine,甲硫胺酸亚砜:sigma公司。
17.实施例1、重链全长重组真核表达载体peedual-h-ires-egfp-h的构建
18.1.1 pee12.4-h-ires-egfp重组载体的构建
19.1、使用引物f1和r1以实验室保存的具有中和活性的scfv质粒为模板pcr扩增vh基因片段;使用引物f2和r2以免疫后鸡法氏囊cdna为模板pcr扩增ch基因片段。
20.f1:5'cgcggatccactggtgccgtgacgttggacgag 3'
21.r1:5'ctagctagcggaggagacgatgacttcggtcc 3'
22.f2:5'ctagctagcgcgagccccacatcgcccccccgat 3'
23.r2:5'ccggaattcattatttaccagcctgtttctgcagcgtg 3'
24.2、用bamhi、nhei将获得的vh片段和pkappa载体进行双酶切,将上述双酶切产物用
1%琼脂糖凝胶电泳回收vh片段和pkappa载体的大片段。
25.3、将胶回收后的vh片段与相同酶切位点的pkappa载体相连,构建重组载体pkappa-vh。
26.4、用hindiii、nhei将重组质粒pkappa-vh进行双酶切,用nhei、ecori将ch片段进行双酶切,用ecori将含有ires-egfp的质粒进行单酶切,pee12.4载体进行hindiii与ecori双酶切,将上述酶切产物用1%琼脂糖凝胶电泳回收含有kappa leader的vh目的片段、ch片段、ires-egfp片段和pee12.4载体回收大片段作为载体片段。将含kappa leader的vh片段、ch片段、ires-egfp片段与pee12.4载体大片段连接,构建重组载体pee12.4-vh-ch-ires-egfp,将其命名为pee12.4-h-ires-egfp。
27.1.2 pee6.4-vh-ch重组载体的构建
28.1、用hindiii、nhei将1.1中获得的重组载体pkappa-vh进行双酶切和用nhei、ecori将1.1中获得的ch片段进行双酶切,pee6.4载体进行hindiii与ecori双酶切,将上述双酶切产物用1%琼脂糖凝胶电泳回收含有kappa leader的vh目的片段、ch片段和pee6.4载体回收大片段作为载体片段。将含kappa leader的vh片段、ch片段与pee6.4载体大片段连接,构建重组载体pee6.4-vh-ch,将其命名为pee6.4-h。
29.1.3重组质粒peedual-h-ires-egfp-h的构建
30.将1.1中获得的pee12.4-h-ires-egfp和1.2中获得的pee6.4-h同时用noti和sali酶切,回收大片段,将回收的两个大片段相连,构建重组质粒peedual-h-ires-egfp-h。
31.实施例2、获得anti-ibdv重链重组全长抗体的cho-k1细胞株
32.cho-k1细胞是谷氨酰胺合成酶(gs)缺陷的中国仓鼠卵巢细胞系,从细胞库中复苏一支cho-k1细胞株,用含有10%胎牛血清含谷氨酰胺的dmem培养基传代两次,当细胞处在对数生长期时,以1
×
10^6cells/ml细胞密度接种于细胞培养瓶,于37℃,5%co2培养箱中培养直至汇合度为70~80%,用胰蛋白酶消化,加血清终止消化,1000rpm,5min,离心后用pbs洗细胞一次,将细胞用无血清mem培养基(gibco公司mem转染用无血清培养基)稀释计数,使其浓度达1
×
10^7cells/ml。取纯化后且不含内毒素的peedual-h-ires-egfp-h质粒dna 5μg,通过lipofectamine 3000试剂盒将质粒转入cho-k1。将转染后的细胞转入含有10%胎牛血清的完全培养基中复苏培养。转染24-30h后更换含50μm gs抑制物甲硫胺酸亚砜(l-methionine sulfoxide,msx),无谷氨酰胺的10%胎牛血清imdm培养基进行加压培养。转染后细胞形态如图1所示,将转染后的细胞命名为h细胞。
33.实施例3、稳定、高效表达anti-ibdv重链全长重组抗体的cho-k1细胞株的筛选
34.本发明在pee12.4载体中引入了增强型绿色荧光蛋白(egfp)基因,在488nm波长光激发下可产生绿色荧光,可通过流式细胞仪进行检测和分选。转染后用含50μm msx,无谷氨酰胺的10%胎牛血清imdm培养基进行加压培养使未转入和瞬时转染的cho-k1细胞淘汰,待稳定转染的克隆长满细胞培养瓶后进行流式细胞仪无菌分选。
35.分选的步骤为:将细胞用胰蛋白酶消化,加血清终止消化,1000rpm,5min,离心后用pbs洗细胞两次,500μl pbs重悬细胞,同样处理未转染的空白细胞作对照。流式细胞仪识别出的阳性率较高的细胞分选到含50μm msx,无谷氨酰胺的10%胎牛血清imdm培养基的六孔板中,37℃,5%co2培养箱中培养并观察,细胞长至约5~10
×
10^6cells后,进行下一轮筛选。
36.三轮筛选完成后,得到阳性率90%以上的混合克隆群,扩大培养,冻存细胞,建立种子细胞库。三轮筛选流式细胞仪检anti-ibdv cho-k1细胞株的结果如图2所示,三筛后在荧光显微镜下的细胞形态如图3所示。
37.实施例4、获得稳定,高效表达的anti-ibdv重链高亲和力的全长重组抗体的cho-k1单克隆细胞株
38.用96孔板单克隆分选方法从三筛得到的混合克隆群中筛选出稳定、高效表达的单克隆细胞株。
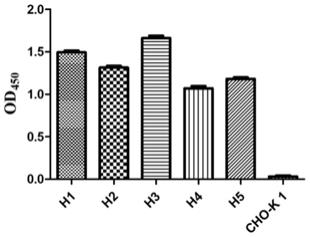
39.单克隆分选方法如下:先将96孔板每孔加入200μl、37℃提前预热的无菌含50μm msx,无谷氨酰胺的10%胎牛血清imdm培养基。细胞处理步骤如实施例3分选步骤,筛选完成后将96孔板置于37℃、5%co2恒温培养箱中培养,1~2周后利用荧光显微镜观察细胞生长情况,并更换培养基,待单克隆细胞增殖到1 000cells以上时,传至24孔培养板,根据细胞增殖数量的增加依次扩大培养,利用流式细胞仪在488nm激发光条件下,检测各单克隆细胞株的荧光强度。流式细胞仪筛选得到anti-ibdv单克隆细胞株检验的结果如图4所示。将得到的anti-ibdv单克隆细胞株培养长满后,换无血清培养基培养细胞4~5天,收取细胞上清,利用elisa方法检测anti-ibdv的重链全长重组抗体(h抗体)的亲和力。elisa的检测方法如下,结果如图5所示,elisa结果表明,anti-ibdv的重链全长重组抗体都可以与vp2蛋白特异性结合,不同单克隆细胞株的结合能力不同,h3单克隆细胞株的结合能力最高,所以选取h3细胞株作为anti-ibdv表达细胞株,扩增培养,冻存细胞。建立种子细胞库。
40.elisa检测anti-ibdv的重链全长重组抗体(h抗体)的亲和力的方法:
41.将ibdv vp2抗原蛋白用包被液稀释至20μg/ml后包被酶标板,4℃过夜。分别加入收集的细胞上清,不加抗体作为阴性对照,加每个样品设置3个复孔。加入hrp标记的羊抗鸡抗体作为第二抗体,用酶标仪检测450nm波长下的a值。
42.实施例5、anti-ibdv重链高亲和力的全长重组抗体的中和活性
43.将处于对数生长期的df1细胞接种于96孔细胞培养板,将用dmem培养基梯度稀释后的h3的重链全长抗体溶液(即实施例4制备的重链抗体溶液)和100tcid
50
的ibdv病毒液(b87株)等体积混合并37℃孵育1h,然后接种到单层细胞中,每一梯度接种8个细胞孔;设置不加入抗体溶液且不加入病毒液的正常对照,设置不加入抗体溶液只加入病毒液的病毒对照。将细胞培养板放到细培养箱中,37℃,5%co2培养连续观察5~7d,每天记录细胞生长状态。结果见表1。
44.表1 anti-ibdv重链高亲和力的全长重组抗体的中和活性测定的结果
[0045][0046]
结果表明,h3抗体具有anti-ibdv的中和活性,阻断或抑制cpe的最小蛋白浓度为0.12μg/ml。
[0047]
实施例6:攻毒治疗试验
[0048]
将28日龄spf鸡随机分为4组,每组10只。除生理盐水组外,其他3组每只鸡口服ibdv bc6/85株0.2ml(100bid
50
)。攻毒后6h、24h、48h对h3重链抗体组、卵黄抗体组各进行三次治疗,每次注射1ml浓度为1mg/ml的抗体,正常组及攻毒组不治疗,逐日观察并记录各组spf鸡发病情况,于攻毒后96h全部扑杀,统计每组中鸡的法氏囊病变的只数。结果见表2。
[0049]
表2攻毒试验
[0050][0051]
结果表明,h3重链抗体可以治疗ibd。
[0052]
实施例7:攻毒预防试验
[0053]
将25日龄spf鸡随机分为4组,每组10只。除生理盐水组和攻毒组外,其他2组每只鸡注射1ml浓度为1mg/ml的h3重链抗体、卵黄抗体。于28日龄攻毒,口服ibdv bc6/85株0.2ml(100bid
50
)。逐日观察并记录各组spf鸡发病情况,攻毒后96h全部扑杀,统计每组中鸡的法氏囊病变的只数。结果见表3。
[0054]
表3攻毒预防试验
[0055][0056]
结果表明,h3重链抗体可以预防ibd。
