抗csf1r分子及其用途
技术领域
1.本公开文本涉及针对人csf-1r的抗体、所述抗体的产生方法、含有所述抗体的药物组合物、及其用途。
背景技术:
2.自从1986年以来就已知csf-1受体(csf-1r;同义词:m-csf受体,巨噬细胞集落刺激因子1受体,ec 2.7.10.1,fms原癌基因,c-fms,swiss prot p07333,cd115)(coussens,l.等人,nature 320(1986)277-280)。csf-1r是一种生长因子,并且由c-fms原癌基因编码(综述于roth,p.和stanley,e.r.,curr.top.microbiol.immunol.181(1992)141-67)。
3.csf-1r是m-csf(巨噬细胞集落刺激因子,也称为csf-1)的受体,并且介导此细胞因子的生物学效应(sherr,c.j.等人,cell 41(1985)665-676)。集落刺激因子-1受体(也称为c-fms)的克隆首次描述于roussel,m.f.等人,nature 325(1987)549-552。在该出版物中,表明csf-1r具有依赖于蛋白质c末端尾部变化的转化潜力,所述变化包括抑制性酪氨酸969磷酸化的丧失,其结合cbl,从而调节受体下调(lee,p.s.等人,embo j.18(1999)3616-3628)。
4.csf-1r是一种单链跨膜受体酪氨酸激酶(rtk)并且是含有免疫球蛋白(ig)基序的rtk家族的成员,其特征在于受体细胞外部分中的重复ig结构域。细胞内蛋白酪氨酸激酶结构域被独特的插入结构域打断,所述插入结构域也存在于其他相关的rtk iii类家族成员中,所述成员包括血小板源性生长因子受体(pdgfr)、干细胞生长因子受体(c-kit)和fins样细胞因子受体(flt3)。尽管此家族的生长因子受体之间具有结构同源性,但它们具有不同的组织特异性功能。csf-1r主要在单核细胞谱系的细胞以及女性生殖道和胎盘中表达。另外,已经报道了csf-1r在皮肤的朗格汉斯细胞、平滑肌细胞亚群(inaba,t.等人,j.biol.chem.267(1992)5693-5699)、b细胞(baker,a.h.等人,oncogene 8(1993)371-378)和小胶质细胞(sawada,m.等人,brain res.509(1990)119-124)中的表达。
5.csf-1r信号传导的主要生物学效应是造血前体细胞向巨噬细胞谱系(包括破骨细胞)的分化、增殖、迁移和存活。csf-1r的激活由其配体m-csf来介导。m-csf与csf-1r的结合诱导同二聚体的形成以及通过酪氨酸磷酸化进行的激酶的活化(stanley,e.r.等人,mol.reprod.dev.46(1997)4-10)。进一步的信号传导由分别连接到pi3k/akt和ras/mapk途径的pi3k和grb2的p85亚基来介导。这两种重要的信号传导途径可以调节增殖、存活和凋亡。结合csf-1r的磷酸化细胞内结构域的其他信号传导分子包括stat1、stat3、plcy和cbl(bourette,r.p.和rohrschneider,l.r.,growth factors 17(2000)155-166)。
6.csf-1r信号传导在免疫反应、骨重建和生殖系统中具有生理学作用。已经显示m-csf-1(pollard,j.w.,mol.reprod.dev.46(1997)54-61)或csf-1r(dai,x.m.等人,blood 99(2002)111-120)的敲除动物具有骨硬化、造血、组织巨噬细胞和生殖表型,这与csf-1r在相应细胞类型中的作用一致。
技术实现要素:
7.在一个方面,本发明提供了一种分离的单克隆抗体或其抗原结合片段,所述单克隆抗体或其抗原结合片段与人csf-1r特异性结合。
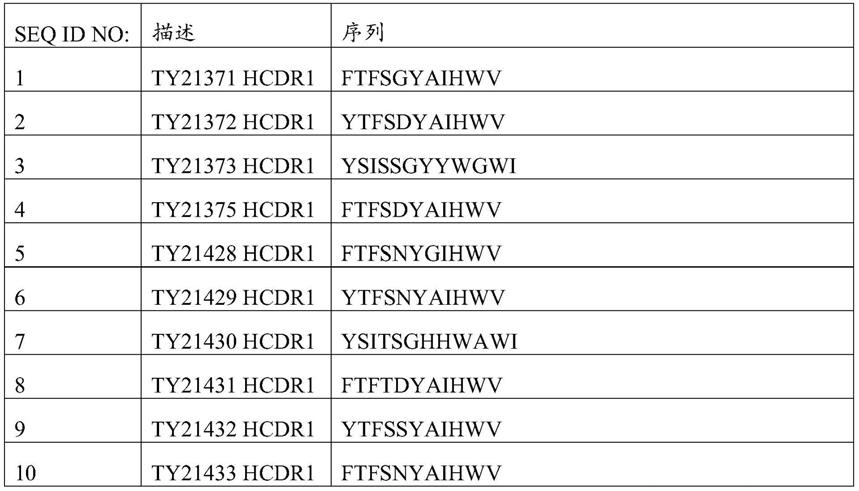
8.在另一个方面,本发明提供了一种分离的单克隆抗体或其抗原结合片段,所述单克隆抗体或其抗原结合片段包含(1)包含如seq id no:1所示的互补决定区(cdr)1、如seq id no:11所示的cdr2和如seq id no:21所示的cdr3的重链可变结构域(vh),以及包含如seq id no:31所示的cdr1、如seq id no:41所示的cdr2和如seq id no:51所示的cdr3的轻链可变结构域(vl);(2)包含如seq id no:2所示的cdr1、如seq id no:12所示的cdr2和如seq id no:22所示的cdr3的vh,以及包含如seq id no:32所示的cdr1、如seq id no:42所示的cdr2和如seq id no:52所示的cdr3的vl;(3)包含如seq id no:3所示的cdr1、如seq id no:13所示的cdr2和如seq id no:23所示的cdr3的vh,以及包含如seq id no:33所示的cdr1、如seq id no:43所示的cdr2和如seq id no:53所示的cdr3的vl;(4)包含如seq id no:4所示的cdr1、如seq id no:14所示的cdr2和如seq id no:24所示的cdr3的vh,以及包含如seq id no:34所示的cdr1、如seq id no:44所示的cdr2和如seq id no:54所示的cdr3的vl;(5)包含如seq id no:5所示的cdr1、如seq id no:15所示的cdr2和如seq id no:25所示的cdr3的vh,以及包含如seq id no:35所示的cdr1、如seq id no:45所示的cdr2和如seq id no:55所示的cdr3的vl;(6)包含如seq id no:6所示的cdr1、如seq id no:16所示的cdr2和如seq id no:26所示的cdr3的vh,以及包含如seq id no:36所示的cdr1、如seq id no:46所示的cdr2和如seq id no:56所示的cdr3的vl;(7)包含如seq id no:7所示的cdr1、如seq id no:17所示的cdr2和如seq id no:27所示的cdr3的vh,以及包含如seq id no:37所示的cdr1、如seq id no:47所示的cdr2和如seq id no:57所示的cdr3的vl;(8)包含如seq id no:8所示的cdr1、如seq id no:18所示的cdr2和如seq id no:28所示的cdr3的vh,以及包含如seq id no:38所示的cdr1、如seq id no:48所示的cdr2和如seq id no:58所示的cdr3的vl;(9)包含如seq id no:9所示的cdr1、如seq id no:19所示的cdr2和如seq id no:29所示的cdr3的vh,以及包含如seq id no:39所示的cdr1、如seq id no:49所示的cdr2和如seq id no:59所示的cdr3的vl;或者(10)包含如seq id no:10所示的cdr1、如seq id no:20所示的cdr2和如seq id no:30所示的cdr3的vh,以及包含如seq id no:40所示的cdr1、如seq id no:50所示的cdr2和如seq id no:60所示的cdr3的vl。
9.在一个实施方案中,本发明的抗体或抗原结合片段包含(1)如seq id no:61所示的vh和如seq id no:71所示的vl;(2)如seq id no:62所示的vh和如seq id no:72所示的vl;(3)如seq id no:63所示的vh和如seq id no:73所示的vl;
(4)如seq id no:64所示的vh和如seq id no:74所示的vl;(5)如seq id no:65所示的vh和如seq id no:75所示的vl;(6)如seq id no:66所示的vh和如seq id no:76所示的vl;(7)如seq id no:67所示的vh和如seq id no:77所示的vl;(8)如seq id no:68所示的vh和如seq id no:78所示的vl;(9)如seq id no:69所示的vh和如seq id no:79所示的vl;或者(10)如seq id no:70所示的vh和如seq id no:80所示的vl。
10.在一个实施方案中,包含上述序列的抗体或抗原结合片段与人csf-1r特异性结合。
11.在一个实施方案中,本发明的抗体或抗原结合片段是igg1或igg4亚类的全长抗体。
12.在一个实施方案中,本发明的抗体或抗原结合片段是具有s241p突变的igg4亚类的全长抗体。
13.在一个实施方案中,本发明的抗体或抗原结合片段是选自fab、fab'、fab-sh、f(ab')2、scfv和双抗体的抗体片段。
14.在一个实施方案中,本发明的抗体或抗原结合片段具有一种或多种以下特性:(1)对人csf-1r具有kd《40nm、《35nm、《30nm、《25nm、《20nm、《15nm、《10nm、《9nm、《8nm、《7nm、《6nm、《5nm、《4nm、《3nm、《2nm、《1nm的亲和力,如通过使用biacore的spr所确定的;(2)与包含如seq id no:81所示的vh和如seq id no:82所示的vl的抗体竞争与人csf-1r的结合;(3)与猴csf-1r结合;(4)不与小鼠csf-1r结合;(5)在储存缓冲液如20mm组氨酸(ph 5.5)中,具有高于80mg/ml、高于90mg/ml、高于100mg/ml、高于110mg/ml、高于120mg/ml、高于130mg/ml或高于134mg/ml的溶解度,而无明显沉淀;(6)在储存缓冲液如20mm组氨酸(ph 5.5)中,与1mg/ml溶液相比,在高浓度下具有少于10%、少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%或少于2%hmw,并且δhmw小于1%、小于0.9%、小于0.8%、小于0.7%、小于0.6%、小于0.5%、小于0.4%或小于0.3%,如通过sec-hplc所分析的;(7)在储存缓冲液如20mm组氨酸(ph 5.5)中,在6个循环的在-80℃下冷冻并在室温下解冻之后保持稳定;(8)在储存缓冲液如20mm组氨酸(ph 5.5)中,在50℃下7天之后保持稳定;(9)抑制由csf-1诱导的csf-1r磷酸化,特别是以剂量依赖性方式,更特别地程度比包含如seq id no:81所示的vh和如seq id no:82所示的vl的抗体更强、相似或更弱;(10)抑制由il-34诱导的csf-1r磷酸化,特别是以剂量依赖性方式,更特别地程度比包含如seq id no:81所示的vh和如seq id no:82所示的vl的抗体更强、相似或更弱;(11)抑制由csf-1诱导的单核细胞增殖,特别是以剂量依赖性方式,更特别地程度比包含如seq id no:81所示的vh和如seq id no:82所示的vl的抗体更强、相似或更弱;
(12)抑制由il-34诱导的单核细胞增殖,特别是以剂量依赖性方式,更特别地程度比包含如seq id no:81所示的vh和如seq id no:82所示的vl的抗体更强、相似或更弱;(13)在食蟹猴中以igg1的形式在10mg/kg的静脉内剂量下,具有大于200μg/ml、大于210μg/ml、大于220μg/ml、大于230μg/ml、大于240μg/ml或大于245μg/ml的平均c
max
,大于15000μg
·
h/ml、大于16000μg
·
h/ml、大于17000μg
·
h/ml、大于18000μg
·
h/ml、大于19000μg
·
h/ml或大于20000μg
·
h/ml的平均auc
0-864h
,和/或大于50h、大于60h、大于70h、大于80h、大于90h或大于100h的平均t
1/2
;(14)在食蟹猴中以igg1的形式在10mg/kg的静脉内剂量下,介导外周血中的cd14
+
cd16
+
单核细胞的快速消除,特别是超过70%、超过80%或超过90%,特别是从给药后第1天至第8天、从给药后第2天至第8天、从给药后第3天至第8天、从给药后第4天至第8天、从给药后第1天至第7天、从给药后第2天至第7天、从给药后第3天至第7天、从给药后第4天至第7天、从给药后第1天至第6天、从给药后第2天至第6天、从给药后第3天至第6天、从给药后第4天至第6天、从给药后第1天至第5天、从给药后第2天至第5天、从给药后第3天至第5天、从给药后第4天至第5天、从给药后第1天至第4天、从给药后第2天至第4天或从给药后第3天至第4天;和/或(15)在食蟹猴中以igg1的形式在10mg/kg的静脉内剂量下,介导血清csf-1水平的快速升高,特别是早至给药后8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23h,或者给药后1、2、3或4天,特别是与给药前基线相比超过10倍、超过20倍、超过30倍、超过40倍、超过50倍、超过60倍、超过70倍、超过80倍、超过90倍、超过100倍、超过200倍、超过300倍、超过400倍、超过500倍、超过600倍、超过700倍、超过800倍、超过900倍或超过1000倍,特别是从给药后第1天至第16天、从给药后第1天至第15天、从给药后第1天至第14天、从给药后第1天至第13天、从给药后第1天至第12天、从给药后第1天至第11天、从给药后第1天至第10天、从给药后第1天至第9天、从给药后第1天至第8天、从给药后第2天至第16天、从给药后第2天至第15天、从给药后第2天至第14天、从给药后第2天至第13天、从给药后第2天至第12天、从给药后第2天至第11天、从给药后第2天至第10天、从给药后第2天至第9天、从给药后第2天至第8天、从给药后第3天至第16天、从给药后第3天至第15天、从给药后第3天至第14天、从给药后第3天至第13天、从给药后第3天至第12天、从给药后第3天至第11天、从给药后第3天至第10天、从给药后第3天至第9天、从给药后第3天至第8天、从给药后第4天至第16天、从给药后第4天至第15天、从给药后第4天至第14天、从给药后第4天至第13天、从给药后第4天至第12天、从给药后第4天至第11天、从给药后第4天至第10天、从给药后第4天至第9天、从给药后第4天至第8天、从给药后第5天至第16天、从给药后第5天至第15天、从给药后第5天至第14天、从给药后第5天至第13天、从给药后第5天至第12天、从给药后第5天至第11天、从给药后第5天至第10天、从给药后第5天至第9天、从给药后第5天至第8天、从给药后第6天至第16天、从给药后第6天至第15天、从给药后第6天至第14天、从给药后第6天至第13天、从给药后第6天至第12天、从给药后第6天至第11天、从给药后第6天至第10天、从给药后第6天至第9天、从给药后第6天至第8天、从给药后第1天至第7天、从给药后第2天至第6天或从给药后第3天至第5,特别是持续1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或16天。
15.本发明提供了一种药物组合物,其包含本发明的抗体或抗原结合片段。
16.本发明提供了至少一种多核苷酸,其编码本发明的抗体或抗原结合片段。
17.本发明提供了至少一种载体,其包含本发明的至少一种多核苷酸。
18.本发明提供了至少一种宿主细胞,其包含本发明的至少一种或多核苷酸或本发明的至少一种载体。
19.本发明提供了一种产生本发明的抗体或抗原结合片段的方法,其包括在适合于表达本发明的至少一种多核苷酸的条件下培养本发明的至少一种宿主细胞,以及任选地回收所述抗体抗原结合片段。
20.本发明提供了一种治疗受试者的疾病、障碍或病症的方法,其包括向所述受试者施用治疗有效量的本发明的抗体或抗原结合片段。
21.本发明提供了本发明的抗体或抗原结合片段在制造用于治疗疾病、障碍或病症的药物中的用途。
附图说明
22.图1示出了抗体与在hek293f细胞表面上瞬时表达的人、猴和小鼠csf-1r的结合。
23.图2示出了在6个循环的冷冻和解冻(左图)或在50℃下储存7天(右图)之后抗体的稳定性。
24.图3示出了抗体对csf-1诱导的csf-1r磷酸化的抑制。
25.图4示出了抗体对il-34诱导的csf-1r磷酸化的抑制。
26.图5示出了抗体对csf-1诱导的单核细胞增殖的抑制。
27.图6示出了抗体对il-34诱导的单核细胞增殖的抑制。
28.图7示出了在10mg/kg的静脉内剂量之后食蟹猴中抗体的pk曲线。
29.图8示出了在10mg/kg的静脉内剂量之后食蟹猴中cd14
+
cd16
+
和cd14
+
cd16-单核细胞数量的变化。
30.图9示出了在10mg/kg的静脉内剂量之后食蟹猴中血清csf-1水平的变化。
具体实施方式
31.术语“抗体”包括各种形式的抗体,包括但不限于完整抗体、抗体片段、人源化抗体、嵌合抗体、人抗体、t细胞表位耗尽的抗体和进一步基因工程化的抗体,只要保留根据本发明的特征特性即可。
[0032]“抗体片段”包含全长抗体的一部分,优选其可变结构域,或至少其抗原结合位点。抗体片段的例子包括fab、fab'、fab-sh、f(ab')2、双抗体、单链抗体分子(例如,scfv)和由抗体片段形成的多特异性抗体。scfv抗体描述于例如houston,j.s.,methods in enzymol.203(1991)46-88。另外,抗体片段包含单链多肽,其具有与csf-1r结合的vh结构域的特征,即能够与v
l
结构域一起组装,或与csf-1r结合的v
l
结构域的特征,即能够与vh结构域一起组装,成为功能性抗原结合位点,从而提供特性。
[0033]
如本文所用的术语“单克隆抗体”或“单克隆抗体组合物”是指具有单一氨基酸组成的抗体分子的制剂。
[0034]
术语“嵌合抗体”是指这样的单克隆抗体,其包含来自小鼠的可变区(即,结合区)和源自不同来源或物种的恒定区的至少一部分,通常通过重组dna技术制备而来。包含小鼠可变区和人恒定区的嵌合抗体是尤其优选的。此类大鼠/人嵌合抗体是所表达的免疫球蛋
白基因的产物,所述免疫球蛋白基因包含编码大鼠免疫球蛋白可变区的dna区段和编码人免疫球蛋白恒定区的dna区段。本发明所包括的“嵌合抗体”的其他形式是类别或亚类已经从原始抗体的类别或亚类修饰或改变的那些。此类“嵌合”抗体也称为“类别转换抗体”。用于产生嵌合抗体的方法涉及本领域目前公知的常规重组dna和基因转染技术。参见例如,morrison,s.l.等人,proc.natl.acad sci.usa 81(1984)6851-6855;us 5,202,238和us 5,204,244。
[0035]
如本技术所用的术语“cdr嫁接变体”表示抗体的可变结构域,其包含来自一种来源或物种的互补决定区(cdr或高变区)和来自不同来源或物种的框架区(fr),通常通过重组dna技术制备而来。包含鼠cdr和人fr的可变结构域的cdr嫁接变体是优选的。
[0036]
如本技术所用的术语“t细胞表位耗尽的变体”表示抗体的可变结构域,其通过去除人t细胞表位(可变结构域内具有与mhc ii类分子结合的能力的肽序列)而被修饰以去除或降低免疫原性。通过此方法,鉴定了可变结构域的氨基酸侧链与具有mhc ii类结合沟的特异性结合口袋之间的相互作用。鉴定出的免疫原区被突变以消除免疫原性。此类方法笼统地描述于例如wo 98/52976。
[0037]
如本技术所用的术语“人源化变体”表示抗体的可变结构域,其由非人起源(例如来自非人物种)的互补决定区(cdr)和人起源的框架区(fr)重建而来,并且其已经被进一步修饰以便还重建或改善原始非人可变结构域的结合亲和力和特异性。此类人源化变体通常通过重组dna技术来制备。重建亲本非人可变结构域的亲和力和特异性是关键步骤,目前使用不同的方法来进行。在一种方法中,确定在非人cdr以及人fr中引入突变(所谓的回复突变)是否有益。可以例如通过以下方式来鉴定此类回复突变的合适位置:通过序列或同源性分析,通过选择人框架(固定框架方法;同源性匹配或最佳拟合),通过使用共有序列,通过从几种不同的人mab中选择fr,或者通过用人mab中最常见的残基替换三维表面上的非人残基(“表面重修”或“镶面”)。
[0038]
另外,根据本发明的抗体包括这样的抗体,其具有“保守序列修饰”,即不影响或改变根据本发明的抗体的上述特征的核苷酸和氨基酸序列修饰。可以通过本领域已知的标准技术(如定点诱变和pcr介导的诱变)引入修饰。保守氨基酸取代包括氨基酸残基被具有相似侧链的氨基酸残基替换的氨基酸取代。本领域已经定义了具有相似侧链的氨基酸残基家族。这些家族包括具有碱性侧链的氨基酸(例如,赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如,天冬氨酸、谷氨酸)、具有不带电的极性侧链的氨基酸(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、具有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、具有β-支链侧链的氨基酸(例如,苏氨酸、缬氨酸、异亮氨酸)和具有芳香族侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,人抗csf-1r抗体中预测的非必需氨基酸残基可以优选地用来自同一侧链家族的另一种氨基酸残基来替换。
[0039]
氨基酸取代可以基于分子建模通过诱变来进行,如riechmann,l.等人,nature 332(1988)323-327和queen,c.等人,proc.natl.acad.sci.usa86(1989)10029-10033所描述的。
[0040]
自从1986年以来就已知csf-1受体(csf-1r;同义词:m-csf受体,巨噬细胞集落刺激因子1受体,ec 2.7.10.1,fms原癌基因,c-fms,swiss prot p07333,cd115)(coussens,
l.等人,nature 320(1986)277-280)。csf-1r是一种生长因子,并且由c-fms原癌基因编码(综述于例如roth,p.和stanley,e.r.,curr.top.microbiol.immunol.181(1992)141-67)。
[0041]
csf-1r是m-csf(巨噬细胞集落刺激因子,也称为csf-1)的受体,并且介导此细胞因子的生物学效应(sherr,c.j.等人,cell 41(1985)665-676)。集落刺激因子-1受体(也称为c-fms)的克隆首次描述于roussel,m.f.等人,nature 325(1987)549-552。在该出版物中,表明csf-1r具有依赖于蛋白质c末端尾部变化的转化潜力,所述变化包括抑制性酪氨酸969磷酸化的丧失,其结合cbl,从而调节受体下调(lee,p.s.等人,embo j.18(1999)3616-3628)。
[0042]
如本文所用,“与人csf-1r结合”是指抗体与人csf-1r抗原特异性结合。结合亲和力在25℃下为1.0x10-8
mol/l或更低的kd值,优选地在25℃下为1.0x10-9
mol/l或更低的kd值。在35℃下通过标准结合测定(如表面等离子体共振技术)确定结合亲和力。
[0043]
术语“表位”表示能够与抗体特异性结合的蛋白质决定簇。表位通常由分子(如氨基酸或糖侧链)的化学活性表面基团组成,并且通常,表位具有特定的三维结构特征以及特定的电荷特征。构象和非构象表位的区别在于,在变性溶剂的存在下,与前者的结合会丧失,但是与后者的结合不会丧失。优选地,根据本发明的抗体与天然csf-1r特异性结合,但是不与变性的csf-1r特异性结合。
[0044]
如本文所用的术语“与参考抗体结合相同的表位”是指本发明的抗csf-1r抗体结合csf-1r上的与参考抗体所结合的表位相同的表位。本发明的抗csf-1r抗体的表位结合特性可以使用本领域已知的技术来确定。在体外竞争性结合抑制测定中,通过表面等离子体共振(spr)在25℃下测量csf-1r抗体,以确定测试抗体抑制参考抗体与csf-1r结合的能力。这可以通过biacore测定(pharmacia biosensor ab,瑞典乌普萨拉)来研究。
[0045]
如本文所用的“可变结构域”(轻链的可变结构域(v
l
)、重链的可变结构域(vh))表示直接参与抗体与抗原结合的轻链和重链结构域对中的每一个。可变轻链和重链结构域具有相同的一般结构,并且每个结构域包含序列广泛保守的四个框架(fr)区,由三个“高变区”(或互补决定区,cdr)连接。框架区采用β-折叠构象,并且cdr可以形成连接β-折叠结构的环。每条链中的cdr通过框架区保持其三维结构,并且与来自另一条链的cdr一起形成抗原结合位点。抗体的重链和轻链cdr3区在根据本发明的抗体的结合特异性/亲和力中起特别重要的作用,因此提供了本发明的另一个目的。
[0046]
术语“抗原结合片段”是术语“抗体的抗原结合部分”的同义词。当在本文使用时,术语“抗体的抗原结合部分”是指抗体的负责抗原结合的氨基酸残基。抗体的抗原结合部分包含来自“互补决定区”或“cdr”的氨基酸残基。“框架”或“fr”区是除如本文所定义的高变区残基以外的那些可变结构域区。因此,抗体的轻链和重链可变结构域从n末端到c末端包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。特别地,重链的cdr3是对抗原结合贡献最大并定义抗体特性的区域。根据kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991)的标准定义和/或来自“高变环”的那些残基来确定cdr和fr区。
[0047]
如本文所用,术语“核酸”或“核酸分子”旨在包括dna分子和rna分子。核酸分子可以是单链的或双链的,但是优选地是双链dna。
[0048]
如本技术所用的术语“氨基酸”表示天然存在的羧基α-氨基酸组,包含丙氨酸(三
字母代码:ala,单字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly,g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、甲硫氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)和缬氨酸(val,v)。
[0049]
本发明的一个实施方案是用于产生根据本发明的针对人csf-1r的抗体的方法,其特征在于将编码与人csf-1r结合的人igg1类别抗体的重链的核酸和编码所述抗体的轻链的核酸的序列插入表达载体中,将所述载体插入真核宿主细胞中,从宿主细胞或上清液中表达并回收所编码的蛋白质。
[0050]
根据本发明的抗体优选地通过重组方式来产生。此类方法在现有技术中是众所周知的,并且包括在原核和真核细胞中表达蛋白质,随后分离抗体多肽并通常纯化至药学上可接受的纯度。为了进行蛋白质表达,通过标准方法将编码轻链和重链或其片段的核酸插入表达载体中。在适当的原核或真核宿主细胞(如cho细胞、ns0细胞、sp2/0细胞、hek293细胞、cos细胞、酵母或大肠杆菌(e.coli)细胞)中进行表达,并且从细胞中(从上清液中或在细胞裂解之后)回收抗体。
[0051]
通过本领域已知的多种方法来制备编码抗csf-1r抗体的氨基酸序列变体的核酸分子。这些方法包括但不限于从天然来源分离(在天然存在的氨基酸序列变体的情况下)或通过人源化抗csf-1r抗体的早期制备的变体或非变体形式的寡核苷酸介导的(或定点)诱变、pcr诱变和盒式诱变制备。
[0052]
将根据本发明的重链和轻链可变结构域与启动子、翻译起始、恒定区、3'非翻译区、聚腺苷酸化和转录终止的序列组合以形成表达载体构建体。可以将重链和轻链表达构建体组合到单个载体中,共转染、连续转染或分别转染到宿主细胞中,然后将其融合以形成表达两条链的单个宿主细胞。
[0053]
抗体的重组产生在现有技术中是公知的,并且描述于例如makrides,s.c.,protein expr.purif.17(1999)183-202;geisse,s.等人,protein expr.purif.8(1996)271-282;kaufman,r.j.,mol.biotechnol.16(2000)151-161;werner,r.g.,drug res.48(1998)870-880的综述文章。
[0054]
抗体可以存在于完整细胞中,存在于细胞裂解物中,或以部分纯化或基本上纯的形式存在。通过标准技术(包括碱性/sds处理、cscl显带、柱层析、琼脂糖凝胶电泳和本领域公知的其他技术)进行纯化以便消除其他细胞组分或其他污染物,例如其他细胞核酸或蛋白质。参见ausubel,f.等人编辑current protocols in molecular biology,greene publishing and wiley interscience,new york(1987)。
[0055]
在ns0细胞中的表达由例如barnes,l.m.等人,cytotechnology32(2000)109-123;和barnes,l.m.等人,biotech.bioeng.73(2001)261-270进行了描述。瞬时表达由例如durocher,y.等人,nucl.acids.res.30(2002)e9进行了描述。可变结构域的克隆由orlandi,r.等人,proc.natl.acad.sci.usa 86(1989)3833-3837;carter,p.等人,proc.natl.acad.sci.usa 89(1992)4285-4289;和norderhaug,l.等人,j.immunol.methods 204(1997)77-87进行了描述。优选的瞬时表达系统(hek 293)由schlaeger,e.-j.和christensen,k.描述于cytotechnology 30(1999)71-83以及由
schlaeger,e.-j.描述于j.immunol.methods 194(1996)191-199。
[0056]
例如,适合于原核生物的控制序列包括启动子、任选的操纵子序列和核糖体结合位点。已知真核细胞利用启动子、增强子和聚腺苷酸化信号。
[0057]
当核酸被放置成与另一个核酸序列具有功能关系时,它是“可操作地连接的”。例如,如果前序列或分泌前导序列的dna被表达为参与多肽分泌的前蛋白,则它与多肽的dna可操作地连接;如果启动子或增强子影响序列的转录,则它与编码序列可操作地连接;或者如果核糖体结合位点被定位以促进翻译,则它与编码序列可操作地连接。通常,“可操作地连接”意味着所连接的dna序列是连续的,并且在分泌前导序列的情况下,是连续的并且在阅读框中。然而,增强子不必是连续的。连接是通过在方便的限制部位进行连接来完成的。如果不存在此类位点,则根据常规实践使用合成的寡核苷酸衔接子或接头。
[0058]
通过常规免疫球蛋白纯化程序(例如像蛋白a-琼脂糖、羟基磷灰石层析、凝胶电泳、透析或亲和层析)将单克隆抗体与培养基适当地分离。编码单克隆抗体的dna和rna易于使用常规程序分离和测序。杂交瘤细胞可以作为这种dna和rna的来源。一旦分离,便可以将dna插入表达载体中,然后将其转染到原本不产生免疫球蛋白的宿主细胞(如hek 293细胞、cho细胞或骨髓瘤细胞)中,以在宿主细胞中获得重组单克隆抗体的合成。
[0059]
如本文所用,表述“细胞”、“细胞系”和“细胞培养物”可互换使用,并且所有这些名称都包括后代。因此,词语“转化体”和“转化的细胞”包括原代主题细胞和由其衍生的培养物,而不考虑转移的数量。还应理解,由于故意或无意的突变,所有后代的dna含量可能不完全相同。包括具有与原始转化的细胞中所筛选的相同功能或生物学活性的变体后代。
[0060]
抗体的“fc部分”不直接参与抗体与抗原的结合,而是表现出各种效应子功能。“抗体的fc部分”是熟练技术人员公知的术语,并且基于抗体的木瓜蛋白酶切割来定义。根据其重链恒定区的氨基酸序列,抗体或免疫球蛋白分为以下类别:iga、igd、ige、igg和igm,并且这些中的一些可以进一步分为亚类(同种型),例如igg1、igg2、igg3、和igg4、iga1、和iga2。根据重链恒定区,不同类别的免疫球蛋白分别称为α、δ、ε、γ和μ。抗体的fc部分直接参与基于补体激活、c1q结合和fc受体结合的adcc(抗体依赖性细胞介导的细胞毒性)和cdc(补体依赖性细胞毒性)。补体激活(cdc)通过补体因子c1q与大多数igg抗体亚类的fc部分结合而启动。虽然抗体对补体系统的影响取决于某些条件,但与c1q的结合是由fc部分中确定的结合位点引起的。此类结合位点在现有技术中是已知的,并且例如由boackle,r.j.等人,nature 282(1979)742-743;lukas,t.j.等人,j.immunol.127(1981)2555-2560;brunhouse,r.和cebra,j.j.,mol.immunol.16(1979)907-917;burton等人,nature 288(1980)338-344;thommesen,j.e.等人,mol.immunol.37(2000)995-1004;idusogie,e.e.等人,j.immunol.164(2000)4178-4184;hezareh,m.等人,j.virology 75(2001)12161-12168;morgan,a.等人,immunology 86(1995)319-324;ep 0307434进行了描述。此类结合位点是例如l234、l235、d270、n297、e318、k320、k322、p331和p329(根据kabat,e.a.的eu索引编号,参见下文)。igg1、igg2和igg3亚类的抗体通常显示出补体激活以及c1q和c3结合,而igg4亚类的抗体不激活补体系统并且不结合c1q和c3。
[0061]
在一个实施方案中,根据本发明的抗体包含源自人起源的fc部分和优选地人恒定区的所有其他部分。如本文所用,术语“源自人起源的fc部分”表示这样的fc部分,其是igg1、igg2、igg3或igg4亚类的人抗体的fc部分,优选来自人igg1亚类的fc部分、来自人
igg1亚类的突变fc部分(优选在l234a+l235a上具有突变)、来自人igg4亚类的fc部分或来自人igg4亚类的突变fc部分(优选在s228p上具有突变)。
[0062]
在一个实施方案中,根据本发明的抗体的特征在于恒定链是人起源的。此类恒定链在现有技术中是公知的,并且例如由kabat,e.a.进行了描述(参见例如johnson,g.和wu,t.t.,nucleic acids res.28(2000)214-218)。进一步优选的是,抗体是小鼠起源的,并且包含根据kabat的小鼠抗体的抗体可变序列框架。
[0063]
本发明包括用于治疗需要治疗的患者的方法,其特征在于向患者施用治疗有效量的根据本发明的抗体。
[0064]
本发明包括根据本发明的抗体用于治疗的用途。
[0065]
因此,根据本发明的与相同表位结合的抗体能够抑制csf-1配体依赖性和csf-1配体非依赖性细胞中的细胞增殖。特别地,本发明的csf-1r抗体用于治疗csf-1配体依赖性和csf-1配体非依赖性csf-1r介导的疾病。这意味着csf1-r介导的疾病依赖于csf-1配体和通过csf-1r进行的相应信号传导和/或独立于csf-1配体和通过csf-1r进行的相应信号传导。通过csf-1r进行的信号传导可能参与肿瘤的生长和转移。
[0066]
本发明的一个实施方案是本发明的用于治疗“csf-1r介导的疾病”的csf-1r抗体或本发明的用于制造治疗“csf-1r介导的疾病”的药物的csf-1r抗体。
[0067]
本发明包括用于治疗疾病、障碍或病症的抗体,其特征在于包含与人csf-1r结合的抗体,所述抗体的特征在于本文提到的表位结合特性或可替代地本文提到的氨基酸序列和氨基酸序列片段。
[0068]
本发明包括抗体用于治疗疾病、障碍或病症或可替代地用于制造治疗疾病、障碍或病症的药物的用途,所述抗体的特征在于包含与人csf-1r结合的抗体,其特征在于本文提到的表位结合特性或可替代地本文提到的氨基酸序列和氨基酸序列片段。
[0069]
在另一个方面,本发明提供了组合物(例如药物组合物),其含有与药学上可接受的载体一起配制的本发明的单克隆抗体中的一种或组合或其抗原结合部分。
[0070]
如本文所用,“药学上可接受的载体”包括生理学上相容的任何和所有溶剂、分散介质、涂层、抗细菌剂和抗真菌剂、等渗剂和吸收/再吸收延迟剂等。优选地,载体适合于注射或输注。
[0071]
本发明的组合物可以通过本领域已知的多种方法来施用。如熟练技术人员将理解的,施用的途径和/或模式将根据期望的结果而变化。
[0072]
药学上可接受的载体包括无菌水性溶液或分散体和用于制备无菌可注射溶液或分散体的无菌粉末。此类介质和试剂用于药物活性物质的用途在本领域是已知的。除了水之外,载体可以是例如等渗缓冲盐水溶液。
[0073]
无论选择何种施用途径,将本发明的化合物(其可以按合适的水合形式使用)和/或本发明的药物组合物通过本领域技术人员已知的常规方法配制成药学上可接受的剂型。
[0074]
本发明的药物组合物中活性成分的实际剂量水平可以变化,以便获得有效实现针对特定的患者、组合物和施用方式所需的治疗反应,而不会对患者有毒的活性成分量(有效量)。所选择的剂量水平将取决于多种药代动力学因素,包括所采用的本发明的特定组合物或其酯、盐或酰胺的活性,施用途径,施用时间,所采用的特定化合物的排泄速率,与所采用的特定组合物组合使用的其他药物、化合物和/或材料,所治疗患者的年龄、性别、体重、状
况、一般健康状况和既往病史,以及医学领域公知的类似因素。
[0075]
本发明包括根据本发明的抗体用于治疗患有疾病、障碍或病症的患者的用途。
[0076]
本发明还包括用于治疗患有疾病、障碍或病症的患者的方法。
[0077]
本发明进一步提供了用于制造药物组合物的方法,所述药物组合物包含有效量的根据本发明的抗体连同药学上可接受的载体;以及根据本发明的抗体用于这种方法的用途。
[0078]
本发明进一步提供了有效量的根据本发明的抗体用于制造治疗患有疾病、障碍或病症的患者的药物组合物(优选地与药学上可接受的载体一起)的用途。
[0079]
所述疾病、障碍或病症是csf-1r介导的疾病、障碍或病症。
[0080]
提供以下实施例和序列表以帮助理解本发明,本发明的真正范围在所附权利要求中阐述。应理解可以在不脱离本发明的精神的情况下对所阐述的程序进行修改。序列描述
实施例与人csf-1r特异性结合的第一fab的发现
[0081]
采用专有的噬菌体文库(参见同时随同提交的标题为“动态人抗体轻链文库(dynamic human antibody light chain libraries)”的pct国际申请,公开号wo 2019/036856,通过引用以其整体并入本文;还参见同时随同提交的标题为“动态人重链抗体文库(dynamic human heavy chain antibody libraries)”的pct国际申请,公开号wo 2019/036842,通过引用以其整体并入本文)来针对人csf-1r抗原(refseq id np_005202)进行淘选。总共进行了三轮淘选。在最后一轮淘选之后,进行单菌落上清液elisa以鉴定特异性识别人csf-1r的主命中。主命中(primary hit)被定义为elisa信号至少是背景信号的两倍的那些命中。对每个主命中的vh和vl的编码区进行测序,在大肠杆菌中表达独特的克隆(作为fab),并通过fortebio octet red96系统进行纯化以进行亲和力测量。简而言之,使用ahc传感器(抗人igg fc捕获浸渍和读取生物传感器)来捕获人csf1r-fc(acrobiosystem,csr-h5258),并且将其浸入含有用动力学缓冲液连续稀释的纯化fab的孔中。用数据采集软件
7.1处理所获取的fortebio数据,并且将动力学数据拟合到1:1langmuir结合模型。总共有53个命中满足以下标准:响应信号高于0.1,r2》0.894和亲和力kd《40nm。然后将其中的12个转化为人igg4(uniprot p01861)或igg1(uniprot p01857),以进行详细的生物物理和功能表征。igg转化和表达
[0082]
将所选择的主命中的重链和轻链分别克隆到具有s241p突变的人igg4同种型的哺乳动物表达载体中。也以相同的方式克隆了两种参考抗体(如us 8,206,715中所述的tac2188和如wo 2013/132044中所述的tac2205)的重链和轻链。转化的igg列于表1中。上文列出了两种参考抗体的重链和轻链可变区。
[0083]
按照制造商的说明将成对的含有重链和轻链的质粒瞬时转染到hek293f细胞中。将上清液收集,通过离心和过滤澄清,并且用标准蛋白a亲和层析(mabselect sure,ge healthcare)纯化igg。将蛋白质洗脱并中和,并且缓冲液交换到20mm组氨酸缓冲液(ph 5.5)中。通过紫外分光光度法确定蛋白质浓度,并且通过sds-page或sec-hplc在变性、还原和非还原条件下分析igg纯度。表位表征
[0084]
通过fortebio表征测试抗体的表位。根据制造商的说明用ez-link磺基-nhs-生物素化试剂盒(thermo fisher scientific#21525)生物素化参考抗体tac2188。之后,将生物素化的参考抗体tac2188用kb缓冲液(补充有0.02%tween 20和0.1%bsa的pbs缓冲液)稀释并加载到sa传感器(pall,185019)上。然后首先将生物传感器浸入含有在kb缓冲液中的人csf1r-his(100nm)的孔中,然后浸入含有在kb缓冲液中的测试抗体(包括另一参考抗体,tac2205)(100nm)的孔中。响应增加表明测试抗体结合人csf-1r上的与固定化抗体所结合的表位不同的表位。如表1所示,两种参考抗体tac2188和tac2205与csf-1r上的不同表位结合,这与公开的数据一致。有趣的是,测试抗体都与tac2188竞争与人csf-1r的结合。表1.转化的igg的结合亲和力和表位表征。
结合亲和力表征
[0085]
根据制造商的指南使用biacore
tm t200仪器(ge,美国)通过表面等离子体共振(spr)分析检查了针对人csf-1r蛋白的抗体的特异性结合亲和力和动力学。根据胺偶联试剂盒(ge biacore#br-1000-50)的说明将抗人igg(fc)抗体(sigma,i2136)固定在cm5芯片上。使用固定化抗人igg(fc)抗体来捕获抗体。以30μl/min的流速经300秒注射8种不同浓度(0.78,1.56,3.13,6.25,12.5,25,50,100)(nm)(在运行缓冲液中稀释)的人csf-1r(人csf1r-his,acrobiosystem,csr-h5228),并且解离时间为300秒。所使用的运行缓冲液为0.01m hepes、0.15m nacl、3mm edta、0.05%(v/v)表面活性剂p20,ph 7.4。在每种情况下,使用没有捕获蛋白质的空白流动池进行相应的对照以进行“背景”减法。根据制造商的指南,使用biacore t200评估软件(ge,美国)将缔合和解离曲线拟合到1:1langmuir结合模型。如表1所列出的,抗体以0.67nm(ty21371)至35.5nm(ty21375)的亲和力结合人csf-1r。
[0086]
还针对在hek293f细胞表面上瞬时表达的人、猴和小鼠csf-1r评估了抗体的特异性(图1)。简而言之,用由双顺反子ires载体表达全长人、猴(refseq id xp_015307616)或小鼠(refseq id np_001032948)csf-1r的质粒转染hek293f细胞。使用egfp来鉴定转染的细胞。40h后,收获转染的细胞,然后将其用1%pbsa缓冲液(在1
×
pbs中的1%(w/v)bsa)洗涤一次。然后将细胞与各种igg(每种为100nm)在室温下一起孵育1h,用预冷的1%pbsa缓冲液洗涤一次,并且与alexa 647缀合的小鼠抗人fc抗体在冰上一起孵育30min。在通过流式细胞术(cytoflex)分析之前,将细胞洗涤一次。如图1所示,所有抗体都展现出与人和猴csf-1r结合,但是它们都不与小鼠csf-1r结合。抗体的可开发性概况
[0087]
为了进行可开发性评估,将纯化的tac2188、ty21371、ty21372和ty21432交换到储存缓冲液(20mm组氨酸,ph 5.5)中。在储存缓冲液中进行所有实验,包括溶解度、在加速胁迫条件下的稳定性和差示扫描荧光(dsf)测试。对于所有sec-hplc分析,使用tskgel柱(tosoh bioscience g3000swxl)。溶解度
[0088]
在没有明显沉淀的情况下,将ty21371、ty21372和ty21432在储存缓冲液中浓缩到高于80mg/ml(表2)。通过sec-hplc进一步分析了高分子量(hmw)聚集体的存在。如表2所示,在高浓度下没有观察到hmw聚集体的显著增加。表2.抗体的高溶解度。在加速胁迫条件下的抗体稳定性
[0089]
还在加速胁迫条件下检查了抗体的稳定性。如图2所示,抗体ty21371、ty21372和ty21432在6个循环的冷冻(-80℃)和解冻(在室温下)之后保持稳定。抗体ty21371、ty21372和ty21432在50℃下七天之后也保持稳定。除ty21372外,hmw聚集体或lmw片段几乎没有增加。对csf-1诱导的csf-1r磷酸化的抑制
[0090]
csf-1(refseq id np_000748)可以激活通过诱导其受体csf-1r的磷酸化进行的细胞信号传导。为了评价各种抗csf1r抗体(包括ty21371、ty21372、ty21432和参考抗体tac2188)抑制由csf-1诱导的csf-1r磷酸化的活性,进行了磷酸elisa测定。简而言之,用表达人csf-1r的质粒转染293t细胞。转染后4h,将细胞以2x104个细胞/孔分到96孔板中,并且在37℃下在5%co2培养箱中培养18h以允许细胞粘附和csf-1r表达。然后,丢弃细胞上清液,并且将连续稀释的测试抗体添加到板中并在37℃下孵育30min。丢弃未结合的抗体溶液,并且将细胞与50ng/ml m-csf再一起孵育5min。然后将细胞立即用dpbs洗涤并裂解。按照制造商的说明用人磷酸m-csfr elisa试剂盒(r&d)分析细胞裂解物中的cfs1r磷酸化水平,并且用spectramax i3x酶标仪在450nm处测量信号。
[0091]
如图3所示,参考抗体tac2188以及ty21371和ty21432可以以剂量依赖性方式抑制csf-1刺激后的csf-1r磷酸化。ty21371表现出比参考抗体tac2188和其他测试抗体更强的对csf-1r磷酸化的抑制。对il-34诱导的csf-1r磷酸化的抑制
[0092]
作为csf-1r的另一种配体,il-34(refseq id np_001166243)也可以激活通过诱导csf-1r的磷酸化进行的csf-1r介导的细胞信号传导。为了评价各种抗csf1r抗体抑制由il-34诱导的csf-1r磷酸化的活性,进行了磷酸elisa。简而言之,用表达人csf-1r的质粒转
染293t细胞。转染后4h,将细胞以2x104个细胞/孔分到96孔板中,并且在37℃下在5%co2培养箱中培养18h以允许细胞粘附和csf-1r表达。然后,丢弃细胞上清液,并且将连续稀释的测试抗体添加到板中并在37℃下孵育30min。丢弃未结合的抗体溶液,并且将细胞与100ng/ml il-34再一起孵育5min。然后将细胞立即用dpbs洗涤并裂解。按照制造商的说明用人磷酸m-csfr elisa试剂盒(r&d)分析细胞裂解物中的cfs1r磷酸化水平,并且用spectramax i3x酶标仪在450nm处测量信号。
[0093]
如图4所示,tac2188强烈阻断il-34刺激后的csf-1r磷酸化,而ty21371的效力稍低,并且ty21432或ty21372展现出弱的对il-34刺激后的csf-1r磷酸化的抑制。对由csf-1诱导的单核细胞增殖的抑制
[0094]
根据制造商的说明用easysep人cd14阳性选择试剂盒(stemcell technologies)分离cd14阳性单核细胞。在rpmi1640完全培养基中以3
×
105个细胞/ml的密度制备细胞。将100μl细胞悬浮液铺板到每个测定孔中,并且与连续稀释的抗体在37℃下一起孵育30min。然后,将50ng/ml m-csf溶液添加到测定孔中,并且在37℃、5%co2培养箱中与细胞再一起孵育5天。使用细胞滴度glo试剂盒(promega)分析单核细胞的增殖。如图5所示,参考抗体tac2188强烈抑制m-csf刺激的单核细胞增殖,而ty21371表现出比ty21372和ty21432更好的阻断活性。对由il-34诱导的单核细胞增殖的抑制
[0095]
根据制造商的说明用easysep人cd14阳性选择试剂盒(stemcell technologies)分离cd14阳性单核细胞。在rpmi1640完全培养基中以1
×
106个细胞/ml的密度制备细胞。将50μl细胞悬浮液铺板到补充有100ng/ml il-34的每个测定孔中。将单核细胞与连续稀释的抗体在37℃、5%co2培养箱中一起孵育5天。使用细胞滴度glo试剂盒(promega)分析单核细胞的增殖。如图6所示,参考抗体tac2188和测试抗体ty21371都可以有效力地抑制il-34刺激的单核细胞增殖。ty21371表现出比参考抗体tac2188更强的抑制。食蟹猴中的药代动力学研究
[0096]
通过以10mg/kg的剂量静脉内输注在未接受过处理的(naive)食蟹猴中进行了ty22179(即,ty21371的igg1形式)和tac2300(即,tac2188的igg1形式)的药代动力学研究。在一组含有1只雄猴和1只雌猴的食蟹猴中研究了每种药物。在给药前、在给药后0.25h、1h、8h、24h、48h、96h、120h、168h、240h、336h、504h、672h和864h收集血清样品。通过elisa分析了ty22179和tac2300的血清药物浓度,其中使用抗原-fc融合物进行捕获,并且使用hrp标记的抗人igg(fab特异性)抗体进行检测。如图7所示,ty22179表现出与参考抗体tac2300相似的pk曲线。在静脉内输注后在所有猴子中都获得了全身暴露。对于ty22179和tac2300,分别地,平均c
max
为249μg/ml或242μg/ml,平均auc
0-864h
为20058μg
·
h/ml或15103μg
·
h/ml,半衰期(t
1/2
)为54-103h或79-89h。食蟹猴中的药效学作用
[0097]
在未接受过处理的食蟹猴中进行了ty22179的药效学研究。向一组猴静脉内施用单剂量(10mg/kg)的ty22179或参考抗体tac2300。每组含有1只雄猴和1只雌猴。对在指定时间点收集的全血样品进行流式细胞术,以分析非经典cd14
+
cd16
+
和经典cd14
+
cd16-单核细胞。还在不同时间点用elisa试剂盒确定csf-1的血清水平。如图8所示,ty22179和参考抗体tac2300都以类似的方式介导了食蟹猴外周血中的非经典cd14
+
cd16
+
单核细胞的快速消除,
但是不介导经典cd14
+
cd16-单核细胞的快速消除。这种作用与这些抗体的作用机制一致。从给药后一周开始,对这些单核细胞产生了强烈的反弹作用,这可能是由于ty22179和参考抗体水平下降的反馈机制所致。这种反弹是短暂的,并且此后非经典cd14
+
cd16
+
单核细胞恢复到正常生理水平。如图9所示,早至抗体给药后8h,血清csf-1水平就迅速升高。增加持续,直到给药后约一周达到稳定,到此时与给药前基线相比,达到了超过1000倍的csf-1水平。然后,csf-1水平开始下降趋势,并且到给药后3-4周恢复到正常生理水平。这种csf-1增加可能会在最初耗尽后推动非经典单核细胞的恢复。
