1.本发明涉及医药技术领域,涉及蟾毒灵的新医药用途,特别是涉及蟾毒灵在制备治疗动脉粥样硬化药物中的应用。
背景技术:
2.蟾毒灵(bufalin)属于甾类固醇化合物,是蟾酥的有效活性成分,而蟾酥是从蟾蜍的皮肤腺和耳后腺分泌干燥后获得的传统东方中药。其分子式为c
24h34
o4,其化学结构式(abcam)如下:
[0003][0004]
蟾毒灵是src-3潜在的抑制剂,通过抑制na
+
,k
+-atpase增加细胞内的na
+
浓度,并通过调节na
+
/ca
2+
泵活性导致细胞内ca
2+
积累,从而导致心肌细胞收缩力增加、血管收缩。蟾毒灵具有强心、抗炎和抗肿瘤等作用。
[0005]
(1)强心作用:蟾毒灵作为一种na
+
,k
+-atpase抑制剂,通过破坏钠泵功能促进心肌细胞钠-钙交换,心肌细胞内钙离子浓度升高而促进心肌收缩力,但不改变心率,在临床上用于心力衰竭、冠心病以及其它心源性疾病的治疗。
[0006]
(2)抗炎作用:蟾酥在中国很早就被用于治疗咽喉发炎和扁桃体炎疾病。蟾酥甾类固醇化合物能通过抑制nf-κb信号通路,降低炎症相关基因的表达比如一氧化氮和前列腺素e2,从而降低毛细血管通透性,减少炎性渗出,有益于消除炎症引起肿胀。已有研究表明蟾毒灵通过抑制nf-κb信号通路降低il-1β、il-6、tnfα、一氧化氮合酶和环氧合酶-2的表达,起到抗炎镇痛作用。
[0007]
(3)抗肿瘤作用:蟾毒灵可以通过增加受体相互作用蛋白rip1/rip3/parp-1通路诱导细胞坏死,进而抑制乳腺癌的发生发展;蟾毒灵也能通过抑制pi3k-akt通路抑制auroraa和aurorab激酶活化,抑制癌细胞的生长,发挥抗肿瘤作用;蟾毒灵还能通过抑制pi3k/akt/mtor通路靶向调节hif-1α表达来抑制肝癌细胞的侵袭和转移。蟾毒灵具有抗癌药的潜力,为蟾毒灵的临床应用提供坚实的理论基础。
[0008]
动脉粥样硬化是心梗死和脑卒中等众多心脑血管疾病共同病理基础。近年来,随着人们生活水平的提高、膳食结构的改变以及世界人口老龄化的加速发展,动脉粥样硬化及相关疾病的发病率和死亡率逐年升高,是当前亟待解决的医学和社会问题。动脉内皮细胞功能紊乱是动脉粥样硬化损伤形成的第一步。在动脉粥样硬化易发部位,enos和sod的表达减少导致内皮屏障受损,从而导致内皮下含ldl和vldl的apob积累和滞留增加。同时,该部位nf-κb通路的激活导致内皮细胞的激活,进而增加vcam-1、icam-1、p选择素、tlr2以及
细胞因子(比如mcp-1和il-8)的表达;此外,内皮细胞激活也能增加活性氧水平,从而氧化ldl转变为oxldl。内皮细胞激活导致单核细胞募集级联反应,包括滚动、粘附、激活以及跨内迁移。巨噬细胞吞噬oxldl转变成泡沫细胞,泡沫细胞又可以分泌众多生长因子和促炎介质,进一步损伤内皮和加剧单核细胞募集,促进斑块生长和炎症反应。
[0009]
目前,对于心肌肥厚的治疗主要包括:1)降脂药物治疗:他汀类药物(statins)和非他汀类降脂药物(pcsk9抑制剂);2)非降脂疗法:抗血小板药物;3)抗炎药物:il-1β抗体康纳单抗(canakinumab);4)生活方式干预等等。上述治疗方式效果有限,亟需发现新的治疗靶点药物。
技术实现要素:
[0010]
本发明的目的是提供蟾毒灵在制备治疗动脉粥样硬化药物中的应用。
[0011]
为实现上述目的,本发明的技术方案如下:
[0012]
本发明的一个方面,提供了蟾毒灵或其药学上可接受的盐、溶剂合物、立体异构体、互变异构体的用途,用于制备治疗动脉粥样硬化药物。
[0013]
优选地,蟾毒灵的浓度为1.0mg/kg。
[0014]
优选地,动脉粥样硬化指高脂食物诱导的动脉粥样硬化。
[0015]
所述的药学上可接受的盐包括本发明化合物与无机酸或有机酸反应形成常规的可药用盐。例如,常规的可药用盐可通过本发明化合物与无机酸或有机酸反应制得,所述无机酸包括盐酸、氢溴酸、硫酸、硝酸、胺基磺酸和磷酸等,以及所述有机酸包括柠檬酸、酒石酸、乳酸、丙酮酸、乙酸、苯磺酸、对甲苯磺酸、甲磺酸、萘磺酸、乙磺酸、萘二磺酸、马来酸、苹果酸、丙二酸、富马酸、琥珀酸、丙酸、草酸、三氟乙酸、硬酯酸、扑酸、羟基马来酸、苯乙酸、苯甲酸、水杨酸、谷氨酸、抗坏血酸、对胺基苯磺酸、2-乙酰氧基苯甲酸和羟乙磺酸等;或者本发明化合物与无机碱形成的钠盐、钾盐、钙盐、铝盐或铵盐;或者本发明化合物与有机碱形成的甲胺盐、乙胺盐或乙醇胺盐。
[0016]“药学上可接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的通式i化合物、其药学上可接受的盐或其溶剂合物以及它们之间相互掺和,而不明显降低活性成分的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0017]
所述药物可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其它物质混合或包裹导入机体。
[0018]
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
[0019]
利用蟾毒灵或其药学上可接受的盐、酯、溶剂合物、立体异构体、互变异构体、前药作为活性成分,单独或组合使用或与其它药物、辅料等配制成各种剂型,包括不限于片剂、
散剂、丸剂、注射剂、胶囊剂、膜剂、栓剂、膏剂、冲剂等多种形式。上述各种剂型的药物均可以按照药学领域的常规方法制备。
[0020]
为达到上述目的,本发明通过以下实验加以验证:
[0021]
1、动物实验:本发明以c57/bl6背景的apoe-/-小鼠为研究对象,通过喂高脂食物建立动脉粥样硬化模型,通过建立蟾毒灵的预防模型和治疗模型,评估蟾毒灵对动脉粥样硬化的治疗效果。蟾毒灵的使用剂量为1mg/kg,通过腹腔注射的方式给药,每天一次,每周6次,连续给药13周。在实验终点,处死小鼠,取主动脉进行油红o染色,采血检测血脂和炎症因子,结果表明,在蟾毒灵的预防模型(图1)和治疗模型中,蟾毒灵对动脉粥样硬化起到一定的保护作用。蟾毒灵可能部分通过nf-κb通路抑制icam-1的表达,进而减少动脉粥样硬化。随后,发明人检测血清中血脂和炎症因子水平,结果表明在预防模型中蟾毒灵不影响血脂水平,而在治疗模型中蟾毒灵升高了血清中总胆固醇和高密度脂蛋白的水平;在预防模型中蟾毒灵显著降低血清中il-6水平,在治疗模型中蟾毒灵显著降低血清中il-6、tnfα和il-1β水平。
[0022]
2、体外细胞学实验:以原代内皮细胞huvec为研究对象,先用蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞,6小时后收样,检测src-3、icam-1、p-p65和p65的表达情况。另外,利用thp-1细胞检测蟾毒灵对单核细胞粘附和跨内皮迁移能力的影响。结果表明,蟾毒灵可能通过nf-κb通路,在转录水平减少icam-1的表达,从而减少单核细胞对huvec内皮细胞的粘附和跨内皮迁移。
[0023]
蟾毒灵可能通过nf-κb通路下调icam-1的表达,从而减少单核细胞对内皮细胞的粘附和跨内皮迁移。
[0024]
本发明公开了以下技术效果:
[0025]
(1)蟾毒灵可以有效治疗高脂食物诱导的动脉粥样硬化,具体机制与nf-κb信号通路有关。
[0026]
(2)蟾毒灵可能通过nf-κb通路减少icam-1的表达,从而减少单核细胞对huvec内皮细胞的粘附和跨内皮迁移。
[0027]
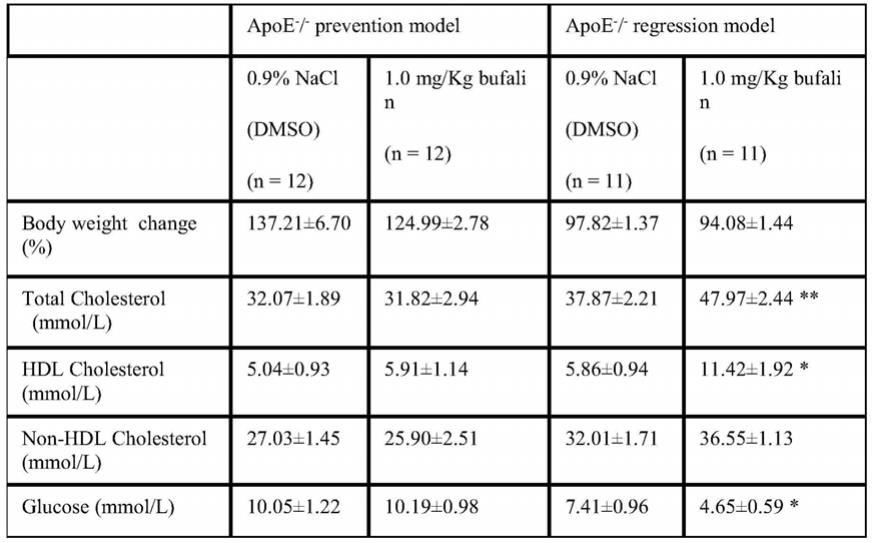
(3)蟾毒灵具备治疗动脉粥样硬化的作用,安全有效,拓展了其应用范围,为动脉粥样硬化的治疗提供新的靶点。
[0028]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。说明书中所揭示的各个特征,可以被任何提供相同、均等或相似目的的替代性特征取代。限于篇幅,在此不再一一赘述。
附图说明
[0029]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图做简单地介绍,显而易见,以下附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0030]
图1:蟾毒灵预防模型小鼠主动脉大体油红o染色情况和主动脉斑块统计结果图
[0031]
a:蟾毒灵预防模型小鼠主动脉大体油红o染色代表性图;
[0032]
b:蟾毒灵预防模型小鼠主动脉斑块统计结果图(***,p<0.001)。
[0033]
图2:蟾毒灵治疗模型小鼠主动脉大体油红o染色情况和主动脉斑块统计结果图
[0034]
a:蟾毒灵治疗模型小鼠主动脉大体油红o染色代表性图;
[0035]
b:蟾毒灵治疗模型小鼠主动脉斑块统计结果图(**,p<0.01)。
[0036]
图3:蟾毒灵预防模型主动脉中src-3、icam-1、p-p65和p65的表达情况图(*,p<0.05)。
[0037]
图4:蟾毒灵治疗模型主动脉中src-3、icam-1、p-p65和p65的表达情况图(*,p<0.05)。
[0038]
图5:蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞的src-3、icam-1、p-p65和p65的蛋白表达情况图。
[0039]
图6:蟾毒灵处理24小时,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理结果图。
[0040]
a:荧光显微镜图;
[0041]
b:粘附huvec的thp1数目与总huvec数目比较图(***,p<0.001)。
[0042]
图7:huvec细胞铺在transwell上面小室,用蟾毒灵处理24小时,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理结果图。
[0043]
a:荧光显微镜图;
[0044]
b:transwell下室中thp1细胞的数目情况图(*,p<0.05)。
[0045]
图8:用蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞的icam-1的mrna表达情况图(**,p<0.01;***,p<0.001)。
[0046]
a:tnfα处理组
[0047]
b:il-1β处理组
[0048]
图9:huvec细胞转染icam-1启动子后,再用蟾毒灵处理24小时,再用tnfα或il-1β处理6小时的荧光素酶活性图(**,p<0.01;***,p<0.001)。
[0049]
a:tnfα处理组
[0050]
b:il-1β处理组
[0051]
图10:src-3和p65募集情况图(**,p<0.01;***,p<0.001)。
[0052]
图11:蟾毒灵处理24小时后,转染icam-1表达质粒过表达icam-1的src-3和icam-1的表达情况图。
[0053]
图12:蟾毒灵处理24小时后,转染icam-1表达质粒过表达icam-1,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理结果图。
[0054]
a:荧光显微镜图;
[0055]
b:粘附huvec的thp1数目与总huvec数目比较图(*,p<0.05;**,p<0.01;***,p<0.001)。
[0056]
图13:huvec细胞铺在transwell上面小室,用蟾毒灵处理24小时,转染icam-1表达质粒过表达icam-1,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理结果图。
[0057]
a:荧光显微镜
[0058]
b:transwell下室中thp1细胞的数目情况图(**,p<0.01;***,p<0.001)。
[0059]
图14:蟾毒灵治疗动脉粥样硬化的可能作用机制图。
具体实施方式
[0060]
本技术的发明人经过广泛而深入地研究,发现蟾毒灵能够改善动脉粥样硬化,下调icam-1的mrna表达,从而减少单核细胞粘附和跨内皮迁移能力,可以用于治疗动脉粥样硬化及其相关疾病。在此基础上,完成了本发明。
[0061]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件(如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件)或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0062]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
[0063]
实施例1体内动脉粥样硬化药理活性测试
[0064]
1、动物实验:本发明以c57/bl6背景的apoe-/-小鼠为研究对象,通过喂高脂食物建立动脉粥样硬化模型,通过建立蟾毒灵的预防模型和治疗模型,评估蟾毒灵对动脉粥样硬化的治疗效果。
[0065]
预防模型:apoe-/-小鼠喂高脂食物13周,同时通过腹腔注射1mg/kg蟾毒灵,每天一次,每周6次,连续给药13周。在实验终点,处死小鼠,取主动脉进行油红o染色,采血检测血脂和炎症因子。对照组和蟾毒灵处理的apoe-/-小鼠主动脉大体油红o染色代表性图片和主动脉斑块统计结果如图1所示。在蟾毒灵预防模型中,主动脉中src-3、icam-1、p-p65和p65的表达情况如图3所示。
[0066]
治疗模型:apoe-/-小鼠喂高脂食物10周后,再腹腔注射1mg/kg蟾毒灵,每天一次,每周6次,连续给药13周。在实验终点,处死小鼠,取主动脉进行油红o染色,采血检测血脂和炎症因子。对照组和蟾毒灵处理的apoe-/-小鼠主动脉大体油红o染色代表性图片和主动脉斑块统计结果如图2所示。在蟾毒灵治疗模型中,主动脉中src-3、icam-1、p-p65和p65的表达情况如图4所示。
[0067]
研究结果表明,在蟾毒灵的预防模型(图1)和治疗模型(图2)中,蟾毒灵对动脉粥样硬化起到一定的保护作用。蟾毒灵可能部分通过nf-κb通路抑制icam-1的表达(图3和图4),进而减少动脉粥样硬化。
[0068]
2、随后,本发明人检测血清中血脂和炎症因子水平,结果表明在预防模型中蟾毒灵不影响血脂水平,而在治疗模型中蟾毒灵升高了血清中总胆固醇和高密度脂蛋白的水平(表1);在预防模型中蟾毒灵显著降低血清中il-6水平,在治疗模型中蟾毒灵显著降低血清中il-6、tnfα和il-1β水平(表2)。
[0069]
表1对照组和蟾毒灵处理的apoe-/-小鼠血清中血糖和血脂水平
[0070][0071]
表2对照组和蟾毒灵处理的apoe-/-小鼠血清中炎症因子表达水平
[0072][0073][0074]
实施例2体外细胞学实验
[0075]
以原代内皮细胞huvec为研究对象,先用蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞,6小时后收样,检测src-3、icam-1、p-p65和p65的表达情况。另外,利用thp-1细胞检测蟾毒灵对单核细胞粘附和跨内皮迁移能力的影响。
[0076]
用蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞,6小时后收样,检测src-3、icam-1、p-p65和p65的蛋白表达情况。结果如图5所示。
[0077]
用蟾毒灵处理24小时,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理6小时,荧光显微镜拍照,计算粘附huvec的thp1数目与总huvec数目比。结果如图6所示。
[0078]
huvec细胞铺在transwell上面小室,用用蟾毒灵处理24小时,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理6小时,荧光显微镜拍照,计算下室中thp1细胞的数目,结果如图7所示。
[0079]
用蟾毒灵处理24小时,再用tnfα或il-1β处理huvec细胞,3小时和6小时后收样,检
测icam-1的mrna表达情况,结果如图8所示。
[0080]
huvec细胞转染icam-1启动子后,再用蟾毒灵处理24小时,再用tnfα或il-1β处理6小时,检测荧光素酶活性,结果如图9所示。
[0081]
huvec用蟾毒灵处理24小时后,用tnfα或il-1β处理6小时,收集细胞进行chip实验,检测src-3和p65被募集到icam-1启动子上情况,结果如图10所示。
[0082]
huvec用蟾毒灵处理24小时后,再转染icam-1表达质粒过表达icam-1,收集蛋白,检测src-3和icam-1的表达情况,结果如图11所示。
[0083]
huvec用蟾毒灵处理24小时后,转染icam-1表达质粒过表达icam-1,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理6小时,荧光显微镜拍照,计算粘附huvec的thp1数目与总huvec数目比(*,p<0.05;**,p<0.01;***,p<0.001),结果如图12所示。
[0084]
huvec细胞铺在transwell上面小室,用用蟾毒灵处理24小时,转染icam-1表达质粒过表达icam-1,加入钙绿素标记的thp1单核细胞,再用tnfα或il-1β处理6小时,荧光显微镜拍照,计算下室中thp1细胞的数目(**,p<0.01;***,p<0.001),结果如图13所示。
[0085]
结果表明,蟾毒灵可能通过nf-κb通路,在转录水平减少icam-1的表达,从而减少单核细胞对huvec内皮细胞的粘附和跨内皮迁移(参见图5-图13),其可能作用机制如图14所示。
[0086]
虽然以上描述了本发明的具体实施方式,但是熟悉本技术领域的技术人员应当理解,我们所描述的具体的实施例只是说明性的,而不是用于对本发明的范围的限定,熟悉本领域的技术人员在依照本发明的精神所作的等效的修饰以及变化,都应当涵盖在本发明的权利要求所保护的范围内。
